
Wetenschap
Wat is een elektrolyt als het in een waterige oplossing wordt geplaatst?
Voorbeelden van elektrolyten zijn zouten (zoals natriumchloride, NaCl), zuren (zoals zoutzuur, HCl) en basen (zoals natriumhydroxide, NaOH). Wanneer deze elektrolyten in water worden opgelost, vallen ze uiteen in hun respectievelijke ionen:
- Natriumchloride (NaCl) valt uiteen in natrium- (Na+) en chloride- (Cl-) ionen.
- Zoutzuur (HCl) valt uiteen in waterstof- (H+) en chloride-ionen (Cl-).
- Natriumhydroxide (NaOH) valt uiteen in natrium- (Na+) en hydroxide- (OH-) ionen.
De resulterende oplossingen bevatten een mengsel van vrije ionen en watermoleculen. De concentratie van deze ionen in de oplossing bepaalt de geleidbaarheid ervan. Hoe hoger de concentratie ionen, hoe beter het vermogen van de oplossing om elektriciteit te geleiden.
Elektrolyten spelen een cruciale rol in verschillende biologische processen, zoals spiercontractie, overdracht van zenuwimpulsen en vochtbalans. Ze hebben ook praktische toepassingen in batterijen, galvaniseren en verschillende industriële processen waarbij elektrochemische reacties betrokken zijn.
 Luchtvervuiling in New York City in verband met bosbranden honderden kilometers verderop
Luchtvervuiling in New York City in verband met bosbranden honderden kilometers verderop Studie van boomringen biedt meer bewijs van poolwaartse migratie van tropische stormen
Studie van boomringen biedt meer bewijs van poolwaartse migratie van tropische stormen Geologisch raadsel opgelost:Roof of the World is hoger geworden
Geologisch raadsel opgelost:Roof of the World is hoger geworden EU gaat de farmaceutische en cosmetische industrie laten betalen voor de behandeling van water
EU gaat de farmaceutische en cosmetische industrie laten betalen voor de behandeling van water  Menselijke aantasting verandert de luchtkwaliteit boven het Amazone-regenwoud
Menselijke aantasting verandert de luchtkwaliteit boven het Amazone-regenwoud
Hoofdlijnen
- Waarom zieke nertsen de zorgen over de vogelgriep doen herleven
- De rol van Taq Polymerase in PCR
- Hoe een beter begrip van het gedrag van hermelijnen de bestrijding van roofdieren in Aotearoa zal helpen
- Hoe krijgen cellen hun vorm? Een nieuw mechanisme geïdentificeerd
- Hoe een ontevreden wetenschapper wilde bewijzen dat zijn voedsel niet nieuw ontdekte radioactieve tracers was en de Nobelprijs won
- Wat bevindt zich buiten een celwand?
- Verbetering van statistische methoden om populaties wilde dieren te beschermen
- Drie soorten dieren die filtervoeding gebruiken om aan voedsel te komen?
- Een nieuwe route naar evolutie:hoe DNA van onze mitochondriën zich een weg baant in onze genomen
- Onderzoek onthult inzichten in enzym dat een algemeen broeikasgas bestrijdt

- Een draagbaar meetapparaat om optimale rijpheid in tomaten te detecteren

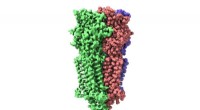
- Cryo-EM onthult structuur en mechanisme van de 5-HT3-receptor
- Nieuwe katalysatoren bootsen de menselijke visie na

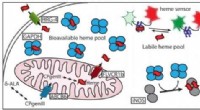
- Hoe cellen omgaan met een kleverige, giftig, maar absoluut essentieel molecuul
 Hoe maak je een door aardappelen aangedreven gloeilamp?
Hoe maak je een door aardappelen aangedreven gloeilamp?  Op weg naar een miljoen keer hogere computerefficiëntie
Op weg naar een miljoen keer hogere computerefficiëntie Qualcomm aangeklaagd door oude partner Arm wegens hoogwaardige chiptechnologie
Qualcomm aangeklaagd door oude partner Arm wegens hoogwaardige chiptechnologie Naarmate grote steden nog groter worden, sommige bewoners worden achtergelaten
Naarmate grote steden nog groter worden, sommige bewoners worden achtergelaten Hoe goede stamcellen van slechte te onderscheiden
Hoe goede stamcellen van slechte te onderscheiden  Jupiter, Saturnus die opgaat in de nachtelijke hemel, het dichtst in eeuwen
Jupiter, Saturnus die opgaat in de nachtelijke hemel, het dichtst in eeuwen Ondanks aarding, United Airlines verwacht nog steeds nieuwe 737 MAX-vliegtuigen in 2019
Ondanks aarding, United Airlines verwacht nog steeds nieuwe 737 MAX-vliegtuigen in 2019 Genomische analyse toont genetische vermenging op lange termijn in West-Azië vóór 's werelds eerste steden
Genomische analyse toont genetische vermenging op lange termijn in West-Azië vóór 's werelds eerste steden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

