
Wetenschap
Welke zou een elektrolytoplossing vormen?
Enkele voorbeelden van stoffen die elektrolytoplossingen vormen zijn:
- Zuren, zoals zoutzuur (HCl) en zwavelzuur (H2SO4)
- Basen, zoals natriumhydroxide (NaOH) en kaliumhydroxide (KOH)
- Zouten, zoals natriumchloride (NaCl) en kaliumnitraat (KNO3)
Wanneer deze stoffen in water worden opgelost, dissociëren ze in hun samenstellende ionen. Wanneer natriumchloride bijvoorbeeld in water wordt opgelost, valt het uiteen in natriumionen (Na+) en chloride-ionen (Cl-). Deze ionen kunnen zich vervolgens vrij door de oplossing bewegen en een elektrische lading met zich meedragen.
Elektrolytoplossingen zijn belangrijk omdat ze een rol spelen in veel biologische processen, zoals zenuwtransmissie, spiercontractie en hartfunctie. Ze worden ook gebruikt in een verscheidenheid aan industriële toepassingen, zoals batterijen, galvaniseren en waterbehandeling.
 Omgevallen trein geeft inzicht in grondbeweging, oorsprong van de aardbeving van 1906
Omgevallen trein geeft inzicht in grondbeweging, oorsprong van de aardbeving van 1906 Pandemie en aanstaande stimuleringsfondsen kunnen klimaatdoelen in zicht brengen - of niet
Pandemie en aanstaande stimuleringsfondsen kunnen klimaatdoelen in zicht brengen - of niet Vandaag is de eerste dag van de herfst, zeggen meteorologen. Maar zo voelt het in het Westen niet
Vandaag is de eerste dag van de herfst, zeggen meteorologen. Maar zo voelt het in het Westen niet Tanzania zegt dat de Kilimanjaro-brand is ingeperkt
Tanzania zegt dat de Kilimanjaro-brand is ingeperkt Texas krijgt te maken met de droogste omstandigheden van de laatste 1, 000 jaar
Texas krijgt te maken met de droogste omstandigheden van de laatste 1, 000 jaar
Hoofdlijnen
- Vogelgriep doodt 700 zwarte gieren, sluit dierenasiel
- Onderzoekers ontwikkelen een systeem om te beoordelen hoe effectief soorten zijn bij het bestuiven van gewassen
- Zijn de hersenen bedraad voor religie?
- Snelle weg naar voedselveiligheid:nieuwe test ontdekt ziekteverwekker in zeevruchten in 30 minuten
- Gewelddadige dromen kunnen een aanwijzing zijn waarom dromen zijn geëvolueerd, zeggen onderzoekers
- Een geprioriteerde lijst van invasieve uitheemse soorten die het milieu van het VK bedreigen
- Evolutie op heterdaad betrapt:wetenschappers meten hoe snel genomen veranderen
- Wat is kenmerkend voor Saurischianen?
- 6 veelvoorkomende hallucinaties en wat ze ons vertellen
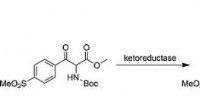
- Synthese van het veterinaire antibioticum florfenicol via een snelle chemo-enzymatische route
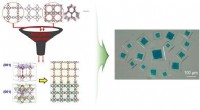
- Algoritme identificeert optimale paren voor het samenstellen van metaal-organische raamwerken
- Ontdekking kan leiden tot krachtiger knoflook, het stimuleren van smaak en slechte adem

- Volgende stap op weg naar een efficiënte biobrandstofcel

- Voorgespannen pleisters voor oude gebouwen

 Milieuvernuft:deze creatieve zakelijke ideeën zijn bedoeld om zowel duurzaam als succesvol te zijn
Milieuvernuft:deze creatieve zakelijke ideeën zijn bedoeld om zowel duurzaam als succesvol te zijn In het tijdperk van Amazon, diensten zoals Birchbox en Dollar Shave Club worden steeds populairder
In het tijdperk van Amazon, diensten zoals Birchbox en Dollar Shave Club worden steeds populairder Nieuw onderzoek combineert geluids- en lichtgolven in siliciumchips om een nieuw type signaalverwerking te creëren
Nieuw onderzoek combineert geluids- en lichtgolven in siliciumchips om een nieuw type signaalverwerking te creëren Extreem zeldzaam Higgs-bosonvervalproces gespot
Extreem zeldzaam Higgs-bosonvervalproces gespot Quantum dots volgen wie in de celkern komt
Quantum dots volgen wie in de celkern komt Promovendus maakt scrubbertextiel ontdekt neutronenanalysetechnieken bij ORNL
Promovendus maakt scrubbertextiel ontdekt neutronenanalysetechnieken bij ORNL Waar wordt kationenuitwisselingshars voor gebruikt?
Waar wordt kationenuitwisselingshars voor gebruikt?  Waarom neemt de druk af als het volume toeneemt?
Waarom neemt de druk af als het volume toeneemt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

