
Wetenschap
Welk type binding is aanwezig in kci?
De ionische binding in KCl komt voort uit het aanzienlijke elektronegativiteitsverschil tussen kalium en chloor. Elektronegativiteit verwijst naar het vermogen van een atoom om elektronen naar zichzelf toe te trekken wanneer het aan een ander atoom is gebonden. Chloor heeft een hogere elektronegativiteit dan kalium, wat betekent dat het een sterkere aantrekkingskracht heeft op elektronen. Dit verschil in elektronegativiteit leidt tot de overdracht van elektronen van kalium naar chloor, wat resulteert in de vorming van ionen en ionische binding.
De sterke elektrostatische krachten tussen K+ en Cl-ionen houden de kristalstructuur van KCl bij elkaar, waardoor het een rigide roosterstructuur krijgt. De regelmatige rangschikking van ionen in KCl resulteert in zijn karakteristieke eigenschappen, zoals hoge smelt- en kookpunten, goede elektrische geleidbaarheid bij oplossing of gesmolten, en brosheid.
 Tyfoon Muifa geselt Oost-China en verdrijft 1,6 miljoen mensen uit hun huizen
Tyfoon Muifa geselt Oost-China en verdrijft 1,6 miljoen mensen uit hun huizen Levenscyclus van een duizendpoot
Levenscyclus van een duizendpoot  Delhi-longen worden in dagen ziekelijk bruin
Delhi-longen worden in dagen ziekelijk bruin Nieuw onderzoek toont effecten van plotselinge droogte in Australië aan
Nieuw onderzoek toont effecten van plotselinge droogte in Australië aan Nieuwe Amerikaanse satelliet om weersvoorspellingen te stimuleren die klaar zijn om te lanceren
Nieuwe Amerikaanse satelliet om weersvoorspellingen te stimuleren die klaar zijn om te lanceren
Hoofdlijnen
- De weggelopen paarden in Londen herinneren ons eraan dat dieren ook werkers zijn
- Het verlenen van rechtspersoonlijkheid aan de natuur is een groeiende beweging:kan dit het verlies aan biodiversiteit tegengaan?
- Nu weten we waarom wortels oranje zijn
- Waarom het aantal haaien langs de oostkust van de VS toeneemt
- Hoe natuurbeschermers Merri Creek in Melbourne terugbrachten van vervuiling, verwaarlozing en onkruid
- Ouders vertonen vooringenomenheid in rivaliteit tussen broers en zussen, zegt onderzoek
- Kan Philly een broeikas voor bananen en ananas worden als het klimaat warmer wordt?
- Onderzoekers ontcijferen hoe een enzym het genetisch materiaal in de celkern wijzigt
- Perfect bewaarde prehistorische leeuwenwelp gevonden in Russische permafrost
- De opmerkelijke variabiliteit van elektronische structuren van actinidetetrafluoride

- Wetenschappers melden een nieuwe cascadereactie

- Nieuwe behandeling ontsluit potentieel voor het bakken van frambozen

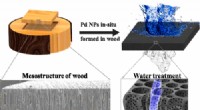
- Houtfilter verwijdert giftige kleurstof uit water
- Het toevoegen van een polymeer stabiliseert instortende metaal-organische raamwerken

 Uit gegevens van MAXI J1820+070 blijkt dat Einstein gelijk had over hoe materie in een zwart gat stort
Uit gegevens van MAXI J1820+070 blijkt dat Einstein gelijk had over hoe materie in een zwart gat stort  De nieuwsgierigheid van cichliden bevordert de biodiversiteit:hoe verkennend gedrag helpt bij ecologische aanpassing
De nieuwsgierigheid van cichliden bevordert de biodiversiteit:hoe verkennend gedrag helpt bij ecologische aanpassing  Genetische studie van prehistorisch meisje:datering en DNA tonen de Paleo-Amerikaanse-Indiaanse connectie aan
Genetische studie van prehistorisch meisje:datering en DNA tonen de Paleo-Amerikaanse-Indiaanse connectie aan  Dodelijke medicijnen? Wetenschappers werpen licht op het duistere geheim van de flacon van koningin Hatsjepsoet
Dodelijke medicijnen? Wetenschappers werpen licht op het duistere geheim van de flacon van koningin Hatsjepsoet  Geboren onder een ongunstige maan, babyvissen vertragen nederzetting op koraalriffen
Geboren onder een ongunstige maan, babyvissen vertragen nederzetting op koraalriffen Rare wolken hebben misschien The Scream geïnspireerd:wetenschappers
Rare wolken hebben misschien The Scream geïnspireerd:wetenschappers Het altijd winnende lot:wiskundigen lossen een stoffig mysterie op
Het altijd winnende lot:wiskundigen lossen een stoffig mysterie op Hoe een Milliequivalent te berekenen
Hoe een Milliequivalent te berekenen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

