
Wetenschap
Onderzoekers vinden nieuwe manier om griepvirus aan te pakken

Onderzoekers van Rice University en Baylor College of Medicine gebruikten computersimulaties om het proces te bestuderen waarmee hemagglutinine virussen helpt cellen binnen te dringen en te infecteren. De onderzoekers geloven dat het stamdomein van het eiwit zich ontvouwt en opnieuw vouwt in een andere configuratie wanneer het wordt geactiveerd, maar pauzeert om een verborgen fusiepeptide vrij te geven dat het virus aan de doelcel bindt. Klik op de afbeelding voor een grotere versie. Krediet:Xingcheng Lin
Er is een storing in de gang van een eiwit dat het griepvirus aflevert. Onderzoekers van Rice University en Baylor College of Medicine geloven dat dit mechanisme een nuttig doelwit kan zijn om te voorkomen dat het virus cellen infecteert.
In een artikel in de Proceedings van de National Academy of Sciences, het Rice-Baylor-team onder leiding van biofysicus José Onuchic en biochemici Jianpeng Ma en Qinghua Wang duikt verder in een glycoproteïnecomplex dat het in een paper uit 2014 begon te definiëren.
Dat eiwit, hemagglutinine, zit op het oppervlak van griepvirussen en helpt ze zich te hechten aan en te transporteren door de beschermende membranen van doelcellen.
Het papier begint het mechanisme te definiëren waardoor het eiwit zich in een handomdraai kan ontvouwen en opnieuw vouwen, het verandert zijn vorm om een peptide bloot te leggen dat het virus aan een cel hecht en een infectie begint. De onderzoekers denken dat therapeutische medicijnen dit mechanisme kunnen gebruiken om het virus te stoppen.
"Dit eiwit begint in een opgevouwen toestand en ondergaat een wereldwijde transformatie, hervouwen in een geheel andere staat, " zei Onuchic, co-directeur van Rice's Centre for Theoretical Biological Physics (CTBP). "Maar er is een klein deel in het centrum dat de evolutie heeft behouden."
Dat ene geconserveerde aminozuurresidu is de hapering die het eiwit laat pauzeren in het proces van hervouwing. Het zorgt ervoor dat een fusie-peptide dat erin is begraven, zich aan de doelcel kan binden en deze begint te infecteren. Zonder pauze, het opnieuw vouwen zou te snel gaan om te binden.
Hoofdauteur en Rice postdoctoraal onderzoeker Xingcheng Lin modelleerde dat deel van het eiwit, de B-loop van het HA2-domein. HA2 zit onder een ander domein, een dop die bekend staat als HA1 en die muteert om aan de verdediging te ontsnappen. Lin legde uit dat HA1 een veelvoorkomend doelwit is voor griepmedicatie omdat het blootgestelde cap-domein toegankelijker is dan het beschermde HA2-domein.
Het probleem is dat HA1 constant muteert om weerstand te bieden aan medicijnen, hij zei. Dat beïnvloedt hoe effectief griepvaccins elk jaar zijn. Lin en Onuchic zeiden dat HA2 een beter doelwit is voor medicijnen omdat het mechanisme sterk geconserveerd is door evolutie.
"Als een medicijn zich richt op HA2, het domein kan niet ontsnappen door mutaties aan te brengen omdat de mutaties zelf het niet-functioneel zouden maken, "Zei Lin. "Dat soort medicijn zou een universeel vaccin kunnen worden."
HA2 is een trimere structuur die, wanneer geactiveerd door zure omstandigheden in de omgeving in de buurt van een doelcel, transformeert zichzelf van een willekeurige lus naar een opgerolde spoel. Zelfs met de pauze, het ontvouwt en hervouwt zich in een fractie van een seconde, veel te snel voor microscopen om te zien. Maar een computersimulatie van het proces kan worden vertraagd.
Dat is toevallig een specialiteit van het CTBP, die programma's gebruikt die het energielandschap van eiwitten analyseren om te voorspellen hoe ze zullen vouwen. Onuchic en zijn collega's zijn pioniers in de theorie dat vouweiwitten een ordelijke, "getrechterd" proces dat afhankelijk is van de intrinsieke energie van elk atoom in de keten, die elk constant hun laagste energietoestand zoeken. Als alle atomaire "kralen" kunnen worden geïdentificeerd, het is mogelijk om het complexe vouwproces te simuleren.
De Rice-onderzoekers gebruiken vaak grofkorrelige modellen van eiwitten, een deelverzameling van atomen die het geheel vertegenwoordigen, om te voorspellen hoe ze zullen folden. De nieuwe studie was veel ambitieuzer en was bedoeld om het complexe ontvouwen en opnieuw vouwen te voorspellen door niet alleen elk atoom in de keten te gebruiken, maar ook elk atoom in zijn vloeibare omgeving, zei Onuchic.
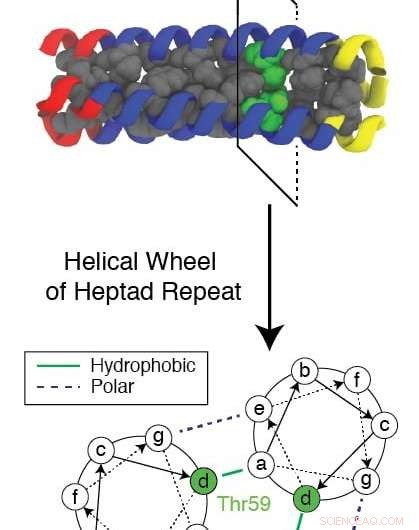
Een evolutionair geconserveerd residu dat bekend staat als Thr59 verstoort het zich herhalende patroon dat wordt gevormd door een trimeer eiwit terwijl het zich opnieuw vouwt, terwijl het een griepvirus helpt een cel te infecteren. Onderzoekers van Rice University en Baylor College of Medicine gebruikten een complexe computersimulatie om het mechanisme te bestuderen en op zoek te gaan naar nieuwe doelen voor medicijnen om de griep te stoppen. Krediet:Xingcheng Lin
Lin modelleerde 40 microseconden (miljoensten van een seconde) van de HA2-domeinovergang die het hele proces vertegenwoordigt, wat 1,4 milliseconden (duizendsten van een seconde) in beslag neemt. Zelfs dat verkorte proces kostte twee jaar computertijd om resultaten op te leveren, hij zei.
"Het gesimuleerde domein is ongeveer 3, 000 atomen, maar wanneer de omgeving, inclusief water, wordt verantwoord, de totale simulatie omvat ongeveer 100, 000 atomen, "Zei Onuchic. "Het is nog steeds een enorme simulatie die de modernste technieken vereiste."
Eerdere theorieën gebaseerd op kristallografische afbeeldingen van de voor-en-na-eiwitten brachten het idee naar voren van een veerbelast domein dat zich na verwijdering van de dop aan de doelcel leek te hechten. Onuchic zei dat het complete model van HA2 een ander mechanisme ondersteunt.
"We kwamen erachter dat er een heleboel energie is die de eindtoestand van HA2 veel stabieler maakt dan de begintoestand, "zei hij. "Maar met het veerbelaste mechanisme, de meeste energie zou al verspild zijn tegen de tijd dat het de opgerolde spoel vormt en de cel- en virale membranen bindt. Het zou geen energie overlaten om de membranen samen te trekken.
"Daarom hebben we besloten om het systeem volledig te berekenen - alle atomen van het eiwit en al het water, "Zei Onuchic. "Het was een gigantische inspanning."
Het geconserveerde hydrofiele (wateraantrekkende) residu, bekend als Thr59, is van bijzonder belang voor de onderzoekers, niet alleen vanwege de manier waarop het de vouwing verstoort en het virus toestaat om aan te vallen, maar ook omdat het een tweeling heeft.
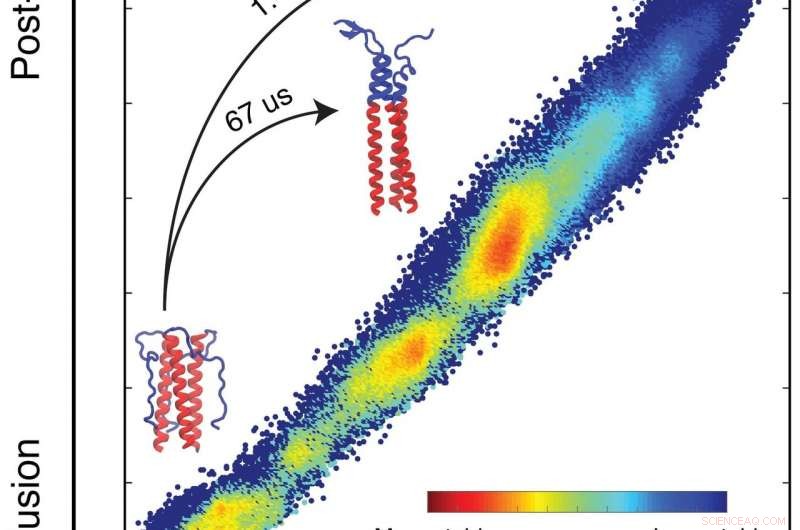
Een simulatie door biofysici van Rice University heeft het vrije-energieprofiel gedetailleerd beschreven dat dicteert hoe een eiwit dat het griepvirus helpt om cellen te infecteren, zijn missie uitvoert. De simulaties voorspellen hoe een eiwit zal vouwen op basis van de intrinsieke energieën van elk atoom in het systeem. De eiwitten vormen lussen en spiralen terwijl ze hun laagste, meest stabiele energietoestanden (blauw). In het domein dat de onderzoekers bestudeerden, ze vonden een hapering die het vouwproces vertraagt waardoor binding aan de doelcel kan plaatsvinden en ook een kans biedt voor nieuwe vaccins om de griep aan te pakken. Klik op de afbeelding voor een grotere versie. Krediet:Xingcheng Lin
"In de volledige evolutionaire boom, deze virussen vallen in twee groepen, en het verschil lijkt dit residu te zijn, " zei Onuchic. "Ze splitsten 1 500 jaar geleden en op de een of andere manier, na deze scheiding, ze zijn volledig geconserveerd. Ze hebben dat residu niet kunnen veranderen, wat er ook gebeurt, en we geloven dat dat dit residu belangrijk maakt."
Het huidige onderzoek richtte zich op de groep die Thr59 bevat en de H3N2-stam veroorzaakt die verantwoordelijk is voor de Hong Kong-griep, zei Lin. Het andere residu, Met59, komt voor in de H1N1-stam die de Spaanse griep veroorzaakte.
"We hebben nog een lange weg te gaan om het hele eiwit te begrijpen, "zei hij. "Hier, we hebben slechts één domein van één eiwit bestudeerd, en er zijn verschillende andere die erg belangrijk zijn voor zijn functie."
"Maar wat Xingcheng al heeft gedaan, is een computationeel hoogstandje, " voegde Onuchic toe. "Hij liet zien hoe dit specifieke residu de spiraalvormige symmetrie van het domein verbreekt en het onstabiel genoeg maakt om het peptide de tijd te geven om de membranen te grijpen."
 Effecten van weersvariabiliteit op de productie van ahornsiroop bestudeerd
Effecten van weersvariabiliteit op de productie van ahornsiroop bestudeerd Van menselijk verkregen kwik is aangetoond dat het de diepste oceaantroggen ter wereld vervuilt
Van menselijk verkregen kwik is aangetoond dat het de diepste oceaantroggen ter wereld vervuilt Studie:Diepzeewezens die een feest of hongersnood leven vanwege energiestromen
Studie:Diepzeewezens die een feest of hongersnood leven vanwege energiestromen Voeradditief vermindert de uitstoot van methaan in de darm bij melkkoeien
Voeradditief vermindert de uitstoot van methaan in de darm bij melkkoeien Dinosaurus-dodende asteroïde-impact koelde het klimaat op aarde meer af dan eerder werd gedacht
Dinosaurus-dodende asteroïde-impact koelde het klimaat op aarde meer af dan eerder werd gedacht
Hoofdlijnen
- Functie van T-cellen in de Thymus Gland
- Het behoud van Jaguar hangt af van de houding van de buren
- Hoe onderhoudt een cel homeostase?
- Genetische ontdekking nog een hulpmiddel in de strijd tegen tarweplagen
- Dierenartsen verplegen zieke bobcat, breng het terug naar het park waar het nodig is
- Projectideeën om het menselijke spijsverteringsstelsel te laten zien op de middelbare school voor studenten
- Wat zijn de twee processen die ATP produceren?
- Maakt Botox je gelukkiger als het je frons wegneemt?
- Onderzoek verduidelijkt de functie van de nucleaire hormoonreceptor in planten
- Onderzoek toont aan hoe elektriciteitsetende microben elektronen gebruiken om koolstofdioxide te fixeren

- Designer-enzym overwint sulfietreductie, een knelpunt bij het opruimen van het milieu

- Reparatie en regeneratie van perifere zenuwen mogelijk met dubbele polymeer hydrogellijm

- Innovatieve methode geeft uniek inzicht in de structuur van cellen en weefsels
- Oplossing voor raadselachtig fenomeen kan de deur openen naar verbeterde koude sproei-efficiëntie
 Cel Life Functies
Cel Life Functies Hoe magnetisatie te berekenen
Hoe magnetisatie te berekenen Bepaalde boomsoorten houden opgeslagen water vast, beperk wortelgroei om drie maanden zonder water te overleven
Bepaalde boomsoorten houden opgeslagen water vast, beperk wortelgroei om drie maanden zonder water te overleven Hoe kun je zien of een kwantumgeheugen echt kwantum is?
Hoe kun je zien of een kwantumgeheugen echt kwantum is? Is groter echt beter?
Is groter echt beter? Robotsmeden:een technologie die de Amerikaanse productie kan doen herleven
Robotsmeden:een technologie die de Amerikaanse productie kan doen herleven Video:Kan Google u helpen de vlekken te verwijderen?
Video:Kan Google u helpen de vlekken te verwijderen? Wetenschappers identificeren nieuwe katalysatoren voor efficiëntere watersplitsing
Wetenschappers identificeren nieuwe katalysatoren voor efficiëntere watersplitsing
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Danish | Norway | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

