
Wetenschap
Wat zouden de productverhoudingen kunnen zijn die in dit experiment zijn waargenomen als er in plaats van water een aprotisch oplosmiddel zoals dimethylsulfoxide was gebruikt?
Als in plaats van water een aprotisch oplosmiddel zoals dimethylsulfoxide (DMSO) was gebruikt, zouden de productverhoudingen anders kunnen zijn geweest. Aprotische oplosmiddelen, die zure waterstofatomen missen, kunnen het reactie-evenwicht beïnvloeden en de productverdeling veranderen. Dit is wat er mogelijk is gebeurd:
1. Verhoogde vorming van de cyclische hydrazone (product A): Aprotische oplosmiddelen zoals DMSO hebben een hogere polariteit dan water, maar nemen minder vaak deel aan waterstofbruggen. Dit betekent dat DMSO niet concurreert met de nucleofiele additie van fenylhydrazine aan de carbonylgroep van cyclohexanon. Als gevolg hiervan zou de vorming van het cyclische hydrazon (product A) in DMSO begunstigd kunnen worden. Het is waarschijnlijker dat de intramoleculaire cyclisatiereactie om het cyclische hydrazon te vormen plaatsvindt in afwezigheid van protische oplosmiddelen zoals water, die de reactie kunnen verstoren door waterstofbruggen te vormen met de reactanten of producten.
2. Verminderde vorming van de open keten hydrazone (Product B): De aanwezigheid van water in het reactiemengsel kan de vorming van hydrazon met open keten (product B) bevorderen via protonenoverdrachtsreacties. Watermoleculen kunnen fungeren als protonenbron, waardoor de protonering van het stikstofatoom in fenylhydrazine wordt vergemakkelijkt. Dit geprotoneerde tussenproduct kan vervolgens een nucleofiele toevoeging aan de carbonylgroep ondergaan, wat leidt tot de vorming van het hydrazon met open keten. In een aprotisch oplosmiddel zoals DMSO zou de afwezigheid van direct beschikbare protonen deze route ongunstig beïnvloeden, wat zou resulteren in een afname van de vorming van product B.
Samenvattend kan het gebruik van een aprotisch oplosmiddel zoals DMSO in plaats van water bij de reactie van cyclohexanon met fenylhydrazine leiden tot een verhoogde vorming van het cyclische hydrazon (product A) en een verminderde vorming van het hydrazon met open keten (product B). De verandering in productverhoudingen is te wijten aan de verschillende solvaterende eigenschappen en de afwezigheid van protische waterstofatomen in DMSO, die de reactieroutes en het evenwicht beïnvloeden.
 Het probleem oplossen:organische damp veroorzaakt het oplossen van moleculaire zouten
Het probleem oplossen:organische damp veroorzaakt het oplossen van moleculaire zouten Zink, een essentieel sporenelement voor de meeste organismen, is aanwezig op de actieve plaats van het enzym carboxypeptidase. Het zink functioneert waarschijnlijk als?
Zink, een essentieel sporenelement voor de meeste organismen, is aanwezig op de actieve plaats van het enzym carboxypeptidase. Het zink functioneert waarschijnlijk als?  Wat is het verschil tussen sulfiden en sulfaten?
Wat is het verschil tussen sulfiden en sulfaten?  Koolstofstaal eigenschappen en toepassingen
Koolstofstaal eigenschappen en toepassingen  Hoe scheid je koolstofdioxide om zuurstof te krijgen?
Hoe scheid je koolstofdioxide om zuurstof te krijgen?
 De menselijke kant van verplaatsing van klimaatverandering begrijpen
De menselijke kant van verplaatsing van klimaatverandering begrijpen Grote natuurlijke koolstofput kan binnenkort koolstofbron worden
Grote natuurlijke koolstofput kan binnenkort koolstofbron worden Burgerwetenschappers verzamelen essentiële gegevens over microplastics - van hun jachten
Burgerwetenschappers verzamelen essentiële gegevens over microplastics - van hun jachten Aanhoudende onbillijke blootstelling aan luchtvervuiling in scholen in Salt Lake County
Aanhoudende onbillijke blootstelling aan luchtvervuiling in scholen in Salt Lake County De wereld wordt geconfronteerd met een wereldwijde zandcrisis
De wereld wordt geconfronteerd met een wereldwijde zandcrisis
Hoofdlijnen
- Feiten over de Spleen
- Machine learning kan wetenschappers helpen begrijpen waarom vogels plastic eten
- Je microben leven voort nadat je sterft – een microbioloog legt uit hoe je necrobioom het lichaam recycleert
- Boek beschrijft alle 451 families van bloeiende planten, varens, lycopoden en naaktzadigen
- Is de zoete erwtenwijnstok een invasieve plant?
- Welke organen helpen het menselijk lichaam zich te ontdoen van verspillingen geproduceerd door cellen?
- Wat als dinosaurussen vandaag nog leefden?
- Hoe worden hormonen door het lichaam getransporteerd?
- Wat de afnemende kariboe-populaties en het totale jachtverbod betekenen voor de Inuit-gemeenschappen in Labrador
- Replicatie van extract van mangosteenschil als behandeling voor darmontsteking bij mens en dier
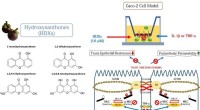
- Geminiaturiseerde neuroprobe voor het nemen van monsters van neurotransmitters in de hersenen

- Een theorie zo helder als glas

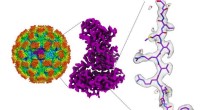
- Norovirusstructuren kunnen helpen bij het ontwikkelen van behandelingen voor voedselvergiftiging
- Wetenschappers creëren chemische tuinen die kunnen worden gebruikt als botvervangende materialen
 Wetenschappers ontdekken nieuw type magneet
Wetenschappers ontdekken nieuw type magneet Snelle foto's laten zien hoe metalen falen
Snelle foto's laten zien hoe metalen falen De haalbaarheid van transformatietrajecten voor het behalen van het Klimaatakkoord van Parijs
De haalbaarheid van transformatietrajecten voor het behalen van het Klimaatakkoord van Parijs Verbrande gebouwen onthullen plundering van oude Turkse stad 3, 500 jaar geleden
Verbrande gebouwen onthullen plundering van oude Turkse stad 3, 500 jaar geleden Een zwevende nanosfeer als ultragevoelige sensor
Een zwevende nanosfeer als ultragevoelige sensor Video:Rijdt uw brandstofcelauto... op benzine?
Video:Rijdt uw brandstofcelauto... op benzine? Defecten in diamant:een uniek platform voor optische gegevensopslag in 3D
Defecten in diamant:een uniek platform voor optische gegevensopslag in 3D  Russisch noordpoolgebied vestigt fantastische hitterecords:weerchef
Russisch noordpoolgebied vestigt fantastische hitterecords:weerchef
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

