
Wetenschap
Wat is de dichtheid van fluorgas bij 7,00 x 102 torr en 27,0C Molaire massa is gelijk aan 38,0 gmol?
PV =nRT
waarbij P de druk is, V het volume, n het aantal mol is, R de ideale gasconstante is en T de temperatuur is.
We kunnen deze vergelijking herschikken om de dichtheid op te lossen, die wordt gedefinieerd als massa per volume-eenheid:
dichtheid =massa/volume =(n * molaire massa)/V
Eerst moeten we de druk omzetten van torr naar atmosfeer (atm):
7,00 x 10^2 torr * (1 atm / 760 torr) =0,921 atm
Vervolgens moeten we de temperatuur omrekenen van graden Celsius (°C) naar Kelvin (K):
27,0 °C + 273,15 =300,15 K
Nu kunnen we het aantal mol fluorgas berekenen met behulp van de ideale gaswet:
n =PV/RT =(0,921 atm * V) / (0,08206 L atm/mol K * 300,15 K)
Omdat we het volume niet weten, laten we het voorlopig op V staan.
Ten slotte kunnen we de dichtheid berekenen:
dichtheid =(n * molaire massa)/V =[(0,921 atm * V) / (0,08206 L atm/mol K * 300,15 K)] * (38,0 g/mol) / V
Vereenvoudiging van de uitdrukking:
dichtheid =(1,458 g/l) * (0,921 atm / V)
Daarom is de dichtheid van fluorgas bij 7,00 x 10^2 torr en 27,0 °C 1,458 g/l, vermenigvuldigd met de verhouding van 0,921 atm tot het volume in liters.
 Optimalisatie van elektrische velden levert betere katalysatoren op
Optimalisatie van elektrische velden levert betere katalysatoren op Video:Hoe je de pittige peperhitte kunt verslaan (hint:melk is niet de beste)
Video:Hoe je de pittige peperhitte kunt verslaan (hint:melk is niet de beste)  Nieuw record voor lengte koolstof-koolstof enkelvoudige binding
Nieuw record voor lengte koolstof-koolstof enkelvoudige binding Nieuwe AI-tool berekent materiaalspanning en -rek op basis van foto's
Nieuwe AI-tool berekent materiaalspanning en -rek op basis van foto's Actieve camouflage kunsthuid in zichtbaar tot infrarood bereik
Actieve camouflage kunsthuid in zichtbaar tot infrarood bereik
 Onderzoekers leggen de wetenschap en geschiedenis uit achter de overgang van oude booreilanden naar permanente riffen
Onderzoekers leggen de wetenschap en geschiedenis uit achter de overgang van oude booreilanden naar permanente riffen Zure oceanen krimpen plankton, snellere klimaatverandering aanwakkeren
Zure oceanen krimpen plankton, snellere klimaatverandering aanwakkeren Gasfakkels presteren enorm ondermaats, met een grotere impact op het klimaat:onderzoek
Gasfakkels presteren enorm ondermaats, met een grotere impact op het klimaat:onderzoek Aanjager van de grootste massa-extinctie in de geschiedenis van de aarde geïdentificeerd
Aanjager van de grootste massa-extinctie in de geschiedenis van de aarde geïdentificeerd Onderzoekers ontdekken dat bosbranden de arctische stroomgebieden 50 jaar lang kunnen veranderen
Onderzoekers ontdekken dat bosbranden de arctische stroomgebieden 50 jaar lang kunnen veranderen
Hoofdlijnen
- Wat zijn de vijf belangrijkste functies van het skeletsysteem?
- Onderzoekers laten zien hoe alternatieven voor vismeel en olie de groei van de aquacultuur kunnen ondersteunen
- Noordelijke blootstelling:fossielen van een zuidelijke walvis voor het eerst gevonden in het noorden
- Eerste referentiegenomen op chromosoomniveau van de sierbanaan en de roze banaan
- Top tien feiten over de menselijke blaas
- Hebben de cellen in veelcellige organismen vaak verschillende maten en vormen?
- Wat is de structuur van een orgaansysteem van een plant?
- Waarom kameleontongen werken in de kou (met video)
- Welke sequentie van RNA-basen vormt een paren DNA-streng die TACTGCA leest?
- Nieuwe plastic biomaterialen kunnen leiden tot hardere, meer veelzijdige medische implantaten
- Onderzoekers tonen aan dat zelfsteriliserende polymeren werken tegen SARS-CoV-2
- Zacht maar sterk:biohybride materiaal presteert als kraakbeen
- Hoe technologieën voor schoon water een boost kunnen krijgen van röntgensynchrotrons

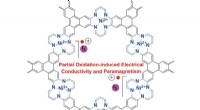
- Nieuw 2D metalen organisch raamwerk met interessante elektrische geleidbaarheid en magnetische eigenschappen
 Team maakt door licht aangedreven nanoonderzeeërs
Team maakt door licht aangedreven nanoonderzeeërs Wat zijn kenmerken van Tornado's?
Wat zijn kenmerken van Tornado's?  Blaarvloeistof kan helpen bij het diagnosticeren van de ernst van brandwonden
Blaarvloeistof kan helpen bij het diagnosticeren van de ernst van brandwonden Studie identificeert honderden ziekenhuizen aan de Atlantische Oceaan en de Golfkust die het risico lopen te overstromen door orkanen
Studie identificeert honderden ziekenhuizen aan de Atlantische Oceaan en de Golfkust die het risico lopen te overstromen door orkanen Natriumacetaat en water chemische vergelijking?
Natriumacetaat en water chemische vergelijking?  Waren dinosaurussen de meest succesvolle dieren op aarde?
Waren dinosaurussen de meest succesvolle dieren op aarde?  Dierlijke productie verantwoordelijk voor het overgrote deel van de luchtkwaliteitsgerelateerde gezondheidseffecten van Amerikaans voedsel
Dierlijke productie verantwoordelijk voor het overgrote deel van de luchtkwaliteitsgerelateerde gezondheidseffecten van Amerikaans voedsel Nanodeeltjes vormgeven voor verbeterde kwantuminformatietechnologie
Nanodeeltjes vormgeven voor verbeterde kwantuminformatietechnologie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

