
Wetenschap
Wat is het verschil tussen het atoomnummer en het gewicht van bekende elementen zoals vermeld in het periodiek systeem?
1. Atoomnummer:
- Het atoomnummer van een element wordt weergegeven door het symbool "Z" en is gelijk aan het aantal protonen dat in de kern van een atoom wordt aangetroffen.
- Het is een unieke identificatie voor elk element en geen twee elementen kunnen hetzelfde atoomnummer hebben.
- Het atoomnummer bepaalt de positie van het element in het periodiek systeem. Elementen zijn gerangschikt in oplopende volgorde van hun atoomnummers.
2. Atoomgewicht:
- Het atoomgewicht van een element, ook wel relatieve atoommassa genoemd, wordt weergegeven door het symbool "A" of "Ar."
- Het is de gewogen gemiddelde massa van alle isotopen van een element, rekening houdend met hun relatieve overvloed.
- Het atoomgewicht houdt rekening met de bijdrage van protonen, neutronen en elektronen in het atoom. De massa van elektronen is echter verwaarloosbaar in vergelijking met protonen en neutronen.
- Het atoomgewicht kan een geheel getal of een decimaal getal zijn, afhankelijk van het element.
In het periodiek systeem wordt het atoomnummer meestal boven het symbool van het element vermeld, terwijl het atoomgewicht onder het symbool staat.
Hier zijn enkele voorbeelden om het verschil tussen atoomnummer en atoomgewicht te illustreren:
- Koolstof (C):Atoomnummer =6, Atoomgewicht =12.011
- Zuurstof (O):Atoomnummer =8, Atoomgewicht =15.999
- Natrium (Na):Atoomnummer =11, Atoomgewicht =22.990
Samenvattend vertegenwoordigt het atoomnummer het aantal protonen en identificeert het op unieke wijze elk element, terwijl het atoomgewicht de gemiddelde massa van alle isotopen van het element vertegenwoordigt.
 Onderzoek naar klimaatverandering laat zien hoe steden prioriteit kunnen geven aan de volksgezondheid
Onderzoek naar klimaatverandering laat zien hoe steden prioriteit kunnen geven aan de volksgezondheid NASA-schadekaart helpt bij natuurbranden in Californië
NASA-schadekaart helpt bij natuurbranden in Californië Overtreft energiedominantie en de toekomst van fossiele brandstoffen
Overtreft energiedominantie en de toekomst van fossiele brandstoffen Vervuiling van individuele schepen vanuit de ruimte detecteren
Vervuiling van individuele schepen vanuit de ruimte detecteren Hoe de eigenaar van een homing-duif te vinden
Hoe de eigenaar van een homing-duif te vinden
Hoofdlijnen
- Science Fair Project Ideas: Equine
- Hoe heet de biomechanische term die het beheer van je kracht definieert terwijl je het evenwicht behoudt?
- Japanse walvisjagers naar Antarctica
- De kern van een cel coördineert processen en activiteiten die in de cel plaatsvinden. welke twee systemen vervullen een soortgelijke functie in het menselijk lichaam?
- Waarom gooit mijn kat overal kattenbakvulling? Vier tips van kattenexperts
- Is teamwetenschap productief? Studie meet het collaboratieve karakter van translationele geneeskunde
- Wat is het genetische principe van segregatie?
- Acht redenen om deze Halloween niet te laten schrikken door spinnen
- Wat is een lentigo?
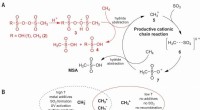
- Methaanoxidatie aan de positieve kant - Een selectieve industriële route naar methaansulfonzuur
- Onderzoekers ontwikkelen smartphonelezer voor snellere infectietests

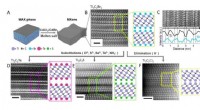
- De ontwikkeling van laagdimensionale nanomaterialen kan een revolutie teweegbrengen in toekomstige technologieën
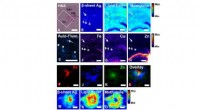
- Gecombineerde beeldvormingsbenadering karakteriseert plaques geassocieerd met de ziekte van Alzheimer
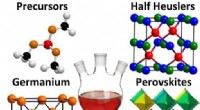
- Een nieuwe strategie om 2-D anorganische materialen te synthetiseren die in condensatoren worden gebruikt, batterijen, en composieten
 Hoe u de houdbaarheid kunt verlengen en voedselverspilling kunt voorkomen
Hoe u de houdbaarheid kunt verlengen en voedselverspilling kunt voorkomen  Veelbelovende nieuwe materialen bootsen spierstructuur en -functie na
Veelbelovende nieuwe materialen bootsen spierstructuur en -functie na Welke aanpassingen moeten Anacondas overkomen?
Welke aanpassingen moeten Anacondas overkomen?  Onderzoekers kraken mengsels van oplosmiddelen puzzel
Onderzoekers kraken mengsels van oplosmiddelen puzzel Japanse AI-tool voorspelt wanneer rekruten hun baan zullen opzeggen
Japanse AI-tool voorspelt wanneer rekruten hun baan zullen opzeggen  Onderzoekers maken wereldwijde arseen-in-grondwaterkaarten om bedreigingen te markeren
Onderzoekers maken wereldwijde arseen-in-grondwaterkaarten om bedreigingen te markeren Supertest evalueert prestaties van technische studenten in Rusland, ONS., Indië, China
Supertest evalueert prestaties van technische studenten in Rusland, ONS., Indië, China Studie onderzoekt nanotechnologie-gerelateerd veiligheids- en ethisch probleem
Studie onderzoekt nanotechnologie-gerelateerd veiligheids- en ethisch probleem
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

