
Wetenschap
Onderzoekers kraken mengsels van oplosmiddelen puzzel
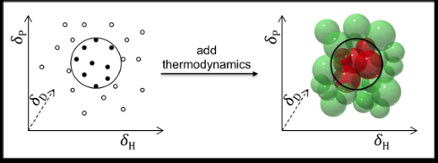
Krediet:HIMS
Chemici van het onderzoekszwaartepunt Duurzame Chemie van de Universiteit van Amsterdam (UvA) hebben samen met het Solvay Lab of the Future in Bordeaux een praktische toolbox ontwikkeld voor het voorspellen van de oplosbaarheid van kleine moleculen in verschillende oplosmiddelen. Deze tools zijn vrij toegankelijk en gratis beschikbaar, en kan de selectie van oplosmiddelen en formuleringen van veel industriële producten verbeteren.
Oplosmiddelen zijn voor veel industriële sectoren van groot belang. Vaak, bij de formulering van een chemisch product vormt het oplosmiddel het grootste deel van de entiteit. Het is ook cruciaal voor de functie van het product. Bijvoorbeeld, met de juiste oplosmiddelformulering, bestrijdingsmiddelen blijven langer op bladeren na regen, verf en inkt drogen sneller, en cosmetica worden gemakkelijker aangebracht. Het kennen van de oplosbaarheid van moleculen is daarom essentieel voor productontwikkeling.
Het probleem met kleine moleculen
De voorspelling van de oplosbaarheid wordt meestal gedaan met behulp van de zogenaamde Hansen-oplosbaarheidsparameters:dispersie (D), polaire interacties (P), en waterstofbinding (H). De coatings- en polymerenindustrie, bijvoorbeeld, behaalt uitstekende resultaten met behulp van deze parameters voor het voorspellen van de oplosbaarheid van polymeren.
In principe, Hansen-parameters kunnen ook worden gebruikt om oplosmiddelen te vinden voor kleinere moleculen zoals medicijnen en cosmetica. Maar daar zijn de voorspellingen niet zo bevredigend, om twee redenen:een, omdat medicijnen en cosmetica doorgaans meer gevarieerde functionele groepen hebben; en twee, omdat de originele Hansen-parameters thermodynamische overwegingen met betrekking tot mengen uitsluiten, smelten en oplossen. Dit is acceptabel voor polymeren (waar de thermodynamica opheft), maar niet voor kleine moleculen.
Dr. Manuel Louwerse en Prof. Gadi Rothenberg, in samenwerking met het team van Dr. Bernard Roux bij Solvay, hebben nu het model van Hansen verbeterd en aangepast om opgeloste stoffen met kleine moleculen te verwerken door de thermodynamica van mengen op te nemen, smelten en oplossen. De verbeteringen zijn gebaseerd op een betere beschrijving van zowel de entropie- als de enthalpietermen. Wanneer een verbinding oplost, moleculen verlaten het kristal en vermengen zich met het oplosmiddel. Dit verhoogt de entropie, maar kost meestal wat enthalpie. Het belangrijkste probleem hier is dat de hoeveelheid entropie die wordt verkregen door mengen bepaalt hoeveel enthalpie verloren kan gaan terwijl een negatieve ∆G behouden blijft (met andere woorden, het handhaven van de drijvende kracht voor de ontbinding). Omdat het entropie-effect afhangt van de concentratie, de temperatuur, en de grootte van de moleculen, deze moeten allemaal worden opgenomen.
Een andere verbetering werd aangebracht door de bijdragen van elektronendonoren en -acceptoren te splitsen tussen het oplosmiddel en de opgeloste stof. Dit is vooral belangrijk voor gevallen zoals waterstofbruggen, wat relevant is voor veel oplosmiddelen en opgeloste stoffen. De mantra 'like lost like' is hier te simplistisch. Er ontstaan waterstofbruggen tussen donoren en acceptanten, dus men heeft donoren nodig om acceptanten te ontbinden, en vice versa. Door de donor- en acceptorbijdragen van elk oplosmiddel en opgeloste stof te splitsen, het UvA-team kreeg nauwkeurigere modellen.
De nieuwe modellen zijn veel beter in het voorspellen van de oplosbaarheid van kleine moleculen in oplosmiddelen en mengsels van oplosmiddelen. Tests op een grote industriële dataset van 15 verschillende opgeloste stoffen en 48 oplosmiddelen en hun mengsels in het Solvay Lab van de Toekomst toonden aan dat de pasvormkwaliteiten verbeterden van 0,89 naar 0,97. Het percentage juiste voorspellingen steeg van 54% naar 78%. Omdat alleen maar raden al 50% correcte voorspellingen zou opleveren, dit is een serieuze verbetering. Een ander belangrijk voordeel is dat het nieuwe model voorspellingen mogelijk maakt bij geëxtrapoleerde temperaturen.
De resultaten en de modellen worden gepubliceerd als een open-access paper in het peer-reviewed internationale tijdschrift ChemPhysChem . De krant heeft al veel opmerkingen gemaakt, en de verbeteringen worden nu verwerkt in een nieuwere versie van de HSPiP-software.
Hoewel de meeste feitelijke industriële formuleringsgegevens vertrouwelijk zijn, het gezamenlijke team heeft de volledige beschrijving van de theorie en de modellen open access gepubliceerd. Ze namen ook de volledige en geannoteerde Matlab-routines op in de ondersteunende informatie, waardoor iedereen deze nieuwe tools kan gebruiken voor het ontwerpen van nieuwe mengsels en formuleringen van oplosmiddelen.
Prof. Rothenberg ziet het publiceren van tools als de sleutel tot succesvolle publiek-private partnerschappen tussen de industrie en de academische wereld. 'Industriële partners moeten hun gegevens vertrouwelijk houden, maar de meesten van hen beseffen dat het open access publiceren van de methoden en tools goodwill creëert en verdere ontwikkelingen door zowel medewerkers als concurrenten mogelijk maakt. Door methoden en tools te delen, bedrijven kunnen profiteren van elkaars kennis zonder data op te offeren.'
 Kleine elektrische velden kunnen een beslissende rol spelen bij de vorming van diamant
Kleine elektrische velden kunnen een beslissende rol spelen bij de vorming van diamant Baanbrekende forensische aanpak om de verkoop van nepdrugs aan te pakken
Baanbrekende forensische aanpak om de verkoop van nepdrugs aan te pakken Onderzoekers ontdekken superelastisch materiaal met vormgeheugen
Onderzoekers ontdekken superelastisch materiaal met vormgeheugen De lading van een atoom bepalen
De lading van een atoom bepalen  Drie voorbeelden van eenvoudige distillatiemixen
Drie voorbeelden van eenvoudige distillatiemixen
 Wat zijn de functies van bloemen en fruit?
Wat zijn de functies van bloemen en fruit?  Mangrove-patches verdienen meer erkenning, ongeacht de grootte
Mangrove-patches verdienen meer erkenning, ongeacht de grootte NASA ziet de wind uit de tropische storm worden geslagen John
NASA ziet de wind uit de tropische storm worden geslagen John Luchtvervuilingsproject maakt gebruik van de kracht van wetenschapsenthousiastelingen in de achtertuin
Luchtvervuilingsproject maakt gebruik van de kracht van wetenschapsenthousiastelingen in de achtertuin Onverschrokken Filippijnse boeren trotseren vulkaanwoede
Onverschrokken Filippijnse boeren trotseren vulkaanwoede
Hoofdlijnen
- Wat zijn de biomoleculen van ribosomen?
- Waarom is chemie belangrijk voor de studie van anatomie en fysiologie?
- Een 3D-model van een plantencel bouwen
- Wat beïnvloedt een Trait Expression de meeste, genetica of de omgeving?
- Studie onderzoekt conflict tussen boeren en roofdieren
- Soorten organellen
- Wat is de belangrijkste primaire producent in het mariene ecosysteem?
- Over de zes koninkrijken
- Sociale omgeving is belangrijk voor de grootte van de eendenpenis
- Een reactie op preparatieve schaal met behulp van platinaclusters met een gerealiseerde eencijferige atomiciteit
- Biologisch afbreekbare glitter en vervuilende microalgen:de nieuwe materialen geïnspireerd door de natuur

- Mistharp vergroot opvangcapaciteit voor schoon water

- Hoe weet ik of iets polair of niet-polair is

- Traditionele geheimen om koel te blijven - onderzoek naar Okinawa-textiel

 Afbeelding:Gedeeltelijke zonsverduistering vanuit de ruimte
Afbeelding:Gedeeltelijke zonsverduistering vanuit de ruimte Het pad van chemicaliën door de bodem volgen
Het pad van chemicaliën door de bodem volgen Rode gloed helpt bij het identificeren van nanodeeltjes voor het leveren van RNA-therapieën
Rode gloed helpt bij het identificeren van nanodeeltjes voor het leveren van RNA-therapieën Het World Wide Web op 29:Tim Berners-Lee praat over bewapening en big tech
Het World Wide Web op 29:Tim Berners-Lee praat over bewapening en big tech Onderzoekers ontwikkelen een nieuw model voor de uitstoot van bosbranden
Onderzoekers ontwikkelen een nieuw model voor de uitstoot van bosbranden Nieuw bewijs voor fragmentatie van energieafgifte bij zonnevlammen
Nieuw bewijs voor fragmentatie van energieafgifte bij zonnevlammen blootstelling aan bomen, de lucht en het gezang van vogels in steden gunstig voor het geestelijk welzijn
blootstelling aan bomen, de lucht en het gezang van vogels in steden gunstig voor het geestelijk welzijn Nieuw ontdekte katapulten van reuzenplaneten rond zijn ster
Nieuw ontdekte katapulten van reuzenplaneten rond zijn ster
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

