
Wetenschap
Waarom zou een stof geleiden als hij gesmolten is, maar niet vast?
Wanneer een stof echter wordt gesmolten, worden de intermoleculaire krachten verzwakt of verbroken, en kunnen de deeltjes gemakkelijker bewegen. Hierdoor kunnen de deeltjes elektrische lading dragen, waardoor gesmolten stoffen elektriciteit kunnen geleiden.
Natriumchloride (NaCl) is bijvoorbeeld een vaste stof bij kamertemperatuur en geleidt geen elektriciteit. Wanneer natriumchloride echter wordt gesmolten, kunnen de ionen (Na+ en Cl-) vrij bewegen en elektrische lading dragen, waardoor de gesmolten substantie elektriciteit kan geleiden.
Samenvattend is het verschil in geleidbaarheid tussen vaste en gesmolten stoffen te wijten aan de mobiliteit van de deeltjes. In een vaste stof zitten de deeltjes vast op hun plaats en kunnen ze niet vrij bewegen, waardoor de stroom van elektrische lading wordt verhinderd. In een gesmolten substantie kunnen de deeltjes vrij bewegen, waardoor ze elektrische lading kunnen dragen en elektriciteit kunnen geleiden.
 Waarom ondergaan alkenen een nucleofiele additiereactie, terwijl dat eenvoudigweg niet het geval is?
Waarom ondergaan alkenen een nucleofiele additiereactie, terwijl dat eenvoudigweg niet het geval is?  Wat is het verschil tussen iconische en covalente bindingen?
Wat is het verschil tussen iconische en covalente bindingen?  Verschil tussen vloeistof en vloeistof
Verschil tussen vloeistof en vloeistof Onderzoek breekt nieuwe wegen in om te begrijpen hoe een moleculaire motor kracht genereert
Onderzoek breekt nieuwe wegen in om te begrijpen hoe een moleculaire motor kracht genereert Onderzoek naar vloeibaar metaal roept Terminator-film op, maar veel vriendelijker
Onderzoek naar vloeibaar metaal roept Terminator-film op, maar veel vriendelijker
 Wil je eerlijkheid? Maak het de gemakkelijkste keuze, suggereert onderzoek
Wil je eerlijkheid? Maak het de gemakkelijkste keuze, suggereert onderzoek  Orkaan Ian zet koers naar Carolina na verwoesting van Florida
Orkaan Ian zet koers naar Carolina na verwoesting van Florida Grote bedrijven zullen binnenkort hun klimaatrisico bekend moeten maken, maar zal het helpen?
Grote bedrijven zullen binnenkort hun klimaatrisico bekend moeten maken, maar zal het helpen? Aardverschuivingen bedreigen de armen in de steden in toenemende mate
Aardverschuivingen bedreigen de armen in de steden in toenemende mate Wat doet de cuticula in een schaduwblad?
Wat doet de cuticula in een schaduwblad?
Hoofdlijnen
- Dogma-uitdagende telomeerbevindingen kunnen nieuwe inzichten bieden voor kankerbehandelingen
- Hoe herhaalbaar is de evolutionaire geschiedenis?
- Leuke wetenschappelijke experimenten op cellen
- Hoe cellulaire vingertoppen cellen kunnen helpen met elkaar te ‘praten’
- De geur die Californische avocado's zou kunnen redden
- Hoe onderwaterplanten en koralen dieren kunnen helpen hittegolven op zee te overleven
- Welk deel van de hersenen controleert emoties?
- Science Fair Ideas With the Topic Dance
- Hoe worden de metaplasmatische materialen in cellen gevormd?
- Eiwitten die tegen de hitte kunnen
- Vergulde panty's inspireren een techniek voor comfortabele, lichtgevende kleding

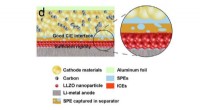
- Onderzoekers ontwerpen dendrietvrije lithiumbatterij
- Door zonlicht aangedreven fotokatalytische watersplitsing voor waterstofproductie op schaal

- Olievangende spons kan resten van offshore-boringen opzuigen

 Wetenschappers tellen keizerspinguïns op Antarctica om factoren te onderzoeken die de bevolking beïnvloeden
Wetenschappers tellen keizerspinguïns op Antarctica om factoren te onderzoeken die de bevolking beïnvloeden  nasa, satellietbedrijf werkt samen om unieke asteroïde te verkennen
nasa, satellietbedrijf werkt samen om unieke asteroïde te verkennen NASA's Aqua Satellite ziet overblijfselen van extra-tropische cycloon Nanmadols ten oosten van Japan
NASA's Aqua Satellite ziet overblijfselen van extra-tropische cycloon Nanmadols ten oosten van Japan Vervuiling door mijnen beperkt de toegang tot schoon water in Papoea-Nieuw-Guinea
Vervuiling door mijnen beperkt de toegang tot schoon water in Papoea-Nieuw-Guinea Koralen die in zeer zoute wateren leven, zijn mogelijk toleranter voor stijgende watertemperaturen
Koralen die in zeer zoute wateren leven, zijn mogelijk toleranter voor stijgende watertemperaturen Schiet op!:G20 aangespoord om digitale belasting te versnellen
Schiet op!:G20 aangespoord om digitale belasting te versnellen Is zoutzuur hetzelfde als zoutzuur?
Is zoutzuur hetzelfde als zoutzuur?  Hoe verandert de openbare ruimte als gevolg van de COVID-19-pandemie?
Hoe verandert de openbare ruimte als gevolg van de COVID-19-pandemie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

