
Wetenschap
Wat is het verschil tussen iconische en covalente bindingen?
1. Elektronenoverdracht versus delen:
- Ionische binding: Bij een ionische binding worden elektronen van het ene atoom naar het andere overgedragen, wat resulteert in de vorming van positief geladen ionen (kationen) en negatief geladen ionen (anionen). De elektrostatische aantrekkingskracht tussen deze ionen houdt de verbinding bij elkaar.
- Covalente binding: Bij een covalente binding worden elektronen gedeeld tussen atomen. Beide atomen dragen elektronen bij om een stabiel elektronenpaar te vormen dat zich in de ruimte tussen de kernen bevindt. Dit gedeelde elektronenpaar vormt de basis voor de covalente binding.
2. Elektronegativiteitsverschil:
- Ionische binding: Ionische bindingen treden op wanneer er een significant verschil in elektronegativiteit is tussen de betrokken atomen. Elektronegativiteit meet het vermogen van een atoom om elektronen aan te trekken. Een groot verschil in elektronegativiteit betekent dat één atoom elektronen sterk aantrekt, wat leidt tot elektronenoverdracht en de vorming van ionen.
- Covalente binding: Covalente bindingen ontstaan wanneer het elektronegativiteitsverschil tussen atomen relatief klein is. De elektronen worden gelijkmatiger verdeeld en er is geen volledige overdracht van elektronen.
3. Elektrische geleidbaarheid:
- Ionische verbinding: Ionische verbindingen zijn over het algemeen goede geleiders van elektriciteit wanneer ze worden opgelost in water of gesmolten. Dit komt omdat de ionen vrij kunnen bewegen in oplossing of gesmolten toestand, waarbij ze de elektrische stroom geleiden.
- Covalente verbinding: Covalente verbindingen zijn doorgaans slechte geleiders van elektriciteit. Omdat de elektronen zich in covalente bindingen bevinden en niet vrij kunnen bewegen, kunnen ze geen elektrische stroom geleiden.
4. Oplosbaarheid:
- Ionische verbinding: Ionische verbindingen zijn vaak oplosbaar in polaire oplosmiddelen, zoals water. De polaire oplosmiddelmoleculen kunnen de ionen omringen en oplossen, waardoor de elektrostatische aantrekking ertussen wordt verbroken en de verbinding kan oplossen.
- Covalente verbinding: Covalente verbindingen zijn over het algemeen onoplosbaar in polaire oplosmiddelen, maar kunnen oplosbaar zijn in niet-polaire oplosmiddelen. Niet-polaire oplosmiddelen hebben geen sterke wisselwerking met de covalente bindingen en kunnen covalente verbindingen oplossen.
5. Hechtsterkte:
- Ionische binding: Ionische bindingen zijn over het algemeen sterker dan covalente bindingen vanwege de sterke elektrostatische aantrekkingskracht tussen tegengesteld geladen ionen.
- Covalente binding: Covalente bindingen kunnen in sterkte variëren, afhankelijk van de betrokken atomen en het aantal gedeelde elektronenparen. Sommige covalente bindingen zijn sterker dan andere.
6. Smelt- en kookpunten:
- Ionische verbinding: Ionische verbindingen hebben doorgaans hogere smelt- en kookpunten in vergelijking met covalente verbindingen. De sterke ionische interacties vereisen een aanzienlijke hoeveelheid energie om de verbinding te laten smelten of koken.
- Covalente verbinding: Covalente verbindingen hebben over het algemeen lagere smelt- en kookpunten vergeleken met ionische verbindingen. De zwakkere covalente bindingen vereisen minder energie om te breken, wat resulteert in lagere smelt- en kookpunten.
Samenvattend omvatten ionische bindingen de overdracht van elektronen en resulteren ze in de vorming van ionen, terwijl covalente bindingen het delen van elektronen tussen atomen inhouden. De verschillen in elektronegativiteit, elektrische geleidbaarheid, oplosbaarheid, bindingssterkte en smelt-/kookpunten helpen onderscheid te maken tussen ionische en covalente bindingen.
 Geheim van Britse chocoladeproductie inspireert ontdekking van nieuwe lactosevorm
Geheim van Britse chocoladeproductie inspireert ontdekking van nieuwe lactosevorm Gestructureerde materialen op meerdere schalen voor elektrokatalyse en foto-elektrokatalyse
Gestructureerde materialen op meerdere schalen voor elektrokatalyse en foto-elektrokatalyse Zwavel verbetert dubbele breking voor het ontwikkelen van vloeibaar-kristallijne moleculen
Zwavel verbetert dubbele breking voor het ontwikkelen van vloeibaar-kristallijne moleculen Realtime monitoringtool versnelt de ontwikkeling van geavanceerde kernreactoren
Realtime monitoringtool versnelt de ontwikkeling van geavanceerde kernreactoren Wetenschappers onthullen dubbele levensduur van zonnebloemenzym
Wetenschappers onthullen dubbele levensduur van zonnebloemenzym
Hoofdlijnen
- Wat is de enige manier waarop een recessieve eigenschap tot uiting komt?
- Welke invloed heeft big data op sportanalyses?
- Wat boeren denken over genetisch gemodificeerde gewassen
- Hebben vogelgezang en menselijke spraak biologische wortels?
- Onderzoekers gebruiken het ritme van DNA-replicatie om kankercellen te doden
- Hoe zijn de hersenen van primaten zo groot geworden?
- Onderzoekers bouwen een biomimetisch 'zacht kanon' om te begrijpen hoe schimmelsporen worden verspreid
- Studie:Hoe we omgaan met dieren werpt licht op de Amerikaanse sociale ongelijkheid
- Kunnen alle levende wezens produceren?
- Snel bewegende elektronen creëren stroom in organische zonnecellen
- Ontwerpen van het perfecte membraan voor schone scheiding van gassen

- Wetenschappers stellen nieuwe strategie voor elektrochemische reductie van kooldioxide voor
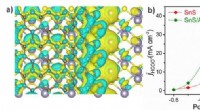
- Nieuwe biocompatibele hybride hydrogels met indrukwekkende mechanische eigenschappen

- Glashelder maken:kristalliniteit vermindert de weerstand in volledig solid-state batterijen
 Unieke moleculaire CODE:paramagnetische codering van moleculen
Unieke moleculaire CODE:paramagnetische codering van moleculen Wereldwijde landbouw:dreigende bedreigingen voor biodiversiteit
Wereldwijde landbouw:dreigende bedreigingen voor biodiversiteit Ontdekking van eendenbekdinosaurus in Marokko:expert ontrafelt het mysterie van hoe ze daar terecht zijn gekomen
Ontdekking van eendenbekdinosaurus in Marokko:expert ontrafelt het mysterie van hoe ze daar terecht zijn gekomen  Adaptieve cruisesystemen zijn niet gelijk
Adaptieve cruisesystemen zijn niet gelijk Ultraheldere röntgenbron wordt wakker in de buurt van een melkwegstelsel niet zo ver weg
Ultraheldere röntgenbron wordt wakker in de buurt van een melkwegstelsel niet zo ver weg Omdat scholen van plan zijn om weer open te gaan, kinderartsen bieden richtlijnen
Omdat scholen van plan zijn om weer open te gaan, kinderartsen bieden richtlijnen Hoe rugpijn te voorkomen
Hoe rugpijn te voorkomen  Wetenschappers bereiken doorbraak in zeer efficiënte elektrokatalysator voor schone energie
Wetenschappers bereiken doorbraak in zeer efficiënte elektrokatalysator voor schone energie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

