
Wetenschap
Dogma-uitdagende telomeerbevindingen kunnen nieuwe inzichten bieden voor kankerbehandelingen
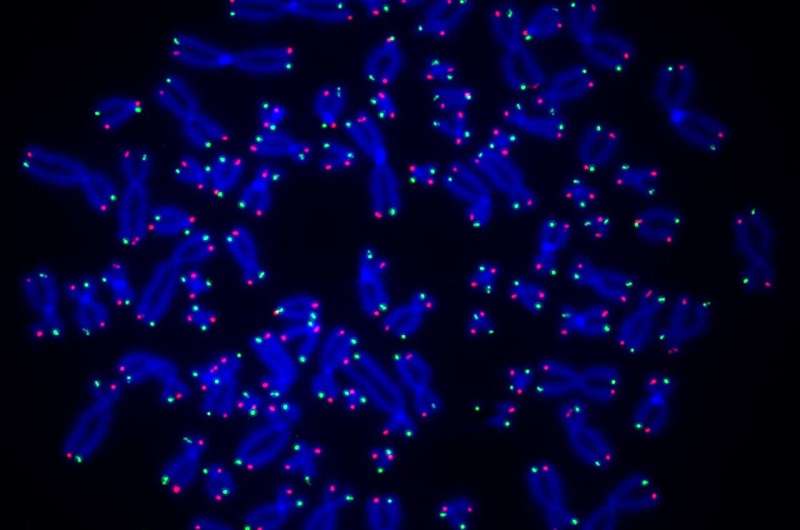
Een nieuwe studie onder leiding van onderzoekers van de Universiteit van Pittsburgh en het UPMC Hillman Cancer Center toont aan dat een enzym genaamd PARP1 betrokken is bij het herstel van telomeren, de stukken DNA die de toppen van chromosomen beschermen, en dat het belemmeren van dit proces kan leiden tot verkorting van telomeren en genomische veranderingen. instabiliteit die kanker kan veroorzaken.
De taak van PARP1 is genoombewaking:wanneer het breuken of laesies in het DNA detecteert, voegt het een molecuul genaamd ADP-ribose toe aan specifieke eiwitten, die fungeren als een baken om andere eiwitten te rekruteren die de breuk herstellen. De nieuwe bevindingen, gepubliceerd in Nature Structural &Molecular Biology zijn het eerste bewijs dat PARP1 ook inwerkt op telomeer DNA, waardoor nieuwe wegen worden geopend voor het begrijpen en verbeteren van PARP1-remmende kankertherapieën.
"Niemand dacht dat ADP-ribosylatie op DNA mogelijk was, maar recente bevindingen dagen dit dogma uit", zegt Roderick O'Sullivan, Ph.D., universitair hoofddocent moleculaire farmacologie Pitt en onderzoeker bij UPMC Hillman. "PARP1 is een van de belangrijkste biomedische doelwitten voor kankeronderzoek, maar men dacht dat medicijnen die zich op dit enzym richten alleen op eiwitten inwerken. Nu we weten dat PARP1 ook DNA modificeert, verandert het de situatie omdat we ons mogelijk op dit aspect van PARP1 kunnen richten. biologie om kankerbehandelingen te verbeteren."
In normale cellen komen genomische laesies van nature voor tijdens DNA-replicatie wanneer een cel zich deelt, en PARP1 speelt een belangrijke rol bij het oplossen van deze fouten. Maar terwijl gezonde cellen andere DNA-reparatieroutes hebben waarop ze kunnen terugvallen, zijn BRCA-deficiënte kankers – waaronder veel borst- en eierstoktumoren – sterk afhankelijk van PARP1 omdat ze BRCA-eiwitten missen, die de meest effectieve vorm van DNA-reparatie controleren, genaamd homologe replicatie.
"Wanneer kankercellen geen BRCA-eiwitten kunnen maken, worden ze afhankelijk van herstelroutes waarbij PARP1 betrokken is", zegt O'Sullivan. "Dus als je PARP1 remt – wat het mechanisme is van verschillende goedgekeurde kankermedicijnen – hebben kankercellen geen herstelroute meer en sterven ze."
Hoewel wetenschappers de rol van PARP1 in ADP-ribosylatie van eiwitten ongeveer 60 jaar geleden ontdekten, hebben O'Sullivan en zijn medewerker, Ivan Ahel, Ph.D., professor aan de Sir William Dunn School of Pathology aan de Universiteit van Oxford en expert in PARP1, had het vermoeden dat er meer te leren was over dit enzym en zijn rol in cellen.
O'Sullivan en zijn team, onder leiding van Anne Wondisford, Ph.D., afgestudeerde student in Pitt's Medical-Scientist Training Program, vergeleken eerst normale menselijke cellen met cellen met een tekort aan PARP1. Met behulp van speciale antilichamen die binden aan ADP-ribose en telomeer-specifieke probes, ontdekten ze dat ADP-ribose zich hecht aan telomeer DNA in normale cellen, maar niet in PARP1-deficiënte cellen, wat aantoont dat dit enzym verantwoordelijk is voor ADP-ribosylatie van DNA. /P>
Vervolgens vergeleken ze normale cellen met cellen die een tekort hebben aan een ander enzym, TARG1 genaamd, dat ADP-ribose verwijdert. Bij afwezigheid van TARG1 hoopte ADP-ribose zich op bij telomeren, wat leidde tot verstoring van de telomeerreplicatie en voortijdige verkorting van telomeren.
Om aan te tonen dat deze telomeerdefecten het gevolg waren van modificatie van telomeer DNA, plaatsten O'Sullivan en zijn team bacteriële enzymen die op dezelfde manier functioneren als PARP1, in menselijke cellen.
"We gebruikten een geleidingssysteem om de enzymen te sturen om ADP-ribose alleen aan de telomeren toe te voegen en nergens anders in het genoom", zegt O'Sullivan. "We ontdekten dat als we telomeren laden met ADP-ribose, hun integriteit dramatisch wordt aangetast, en dat het de cel binnen enkele dagen kan doden."
O'Sullivan veronderstelt dat ADP-ribose de integriteit van telomeren aantast door een beschermende structuur te verstoren, genaamd shelter, die telomeren beschermt, maar er is meer onderzoek nodig om dit te bevestigen.
"Het richten op PARP1 is een groot succesverhaal geweest voor kankertherapie, maar sommige patiënten ontwikkelen resistentie tegen PARP1-remmers", zegt O'Sullivan. "Ik ben enthousiast over deze studie omdat we iets nieuws hebben ontdekt over de PARP1-biologie, wat een hele reeks nieuwe vragen oplevert die ons kunnen helpen nieuwe benaderingen te ontwikkelen om PARP1 te targeten of de therapieën die we al hebben te verfijnen. We hebben gelijk aan het begin van iets spannends, en er valt nog veel meer te ontdekken."
Andere auteurs van het onderzoek waren Sandra Schamus-Haynes, Ragini Bhargava Ph.D., en Patricia Opresko, Ph.D., allemaal van Pitt en UPMC; Junyeop Lee en Jaewon Min, Ph.D., beiden van Columbia University; Robert Lu, Ph.D., en Hilda Pickett, Ph.D., beiden van de Universiteit van Sydney; en Marion Schuller, D.Phil., en Josephine Groslambert, beiden van de Universiteit van Oxford.