
Wetenschap
Wat heeft John Dalton bijgedragen aan het begrip van het atoom?
De wet van behoud van massa: Volgens de wet van Dalton kan er bij een chemische reactie geen massa ontstaan of vernietigd worden. De totale massa van de producten in een reactie is gelijk aan de totale massa van de reactanten.
De wet van bepaalde proporties: De wet van Dalton stelt dat wanneer twee elementen samenkomen om een verbinding te vormen, ze dit altijd in een vaste en bepaalde massaverhouding doen. Deze wet ondersteunt het idee dat atomen van verschillende elementen verschillende massa's hebben.
Meerdere verhoudingen: Dalton merkte op dat wanneer twee elementen meer dan één verbinding vormen, de massa's van het ene element, gecombineerd met een vaste massa van het andere element, zich in een eenvoudige verhouding van gehele getallen bevinden. Dit concept hielp verklaren waarom elementen in specifieke verhoudingen combineren om verschillende verbindingen te vormen.
Atoomsymbolen: Dalton introduceerde het gebruik van eenvoudige symbolen om verschillende elementen weer te geven. Deze symbolen, zoals "O" voor zuurstof en "H" voor waterstof, maakten het gemakkelijker om chemische formules te schrijven en over verbindingen te communiceren.
Empirische formules: Daltons werk op het gebied van atoomgewichten en meerdere verhoudingen leidde tot de ontwikkeling van empirische formules, die de eenvoudigste gehele getalsverhoudingen weergeven van elementen die in een verbinding aanwezig zijn.
Daltons bijdragen aan het begrip van het atoom legden de basis voor de moderne chemie. Zijn theorie en wetten vormden een raamwerk voor het begrijpen van de samenstelling en het gedrag van materie, en vormden daarmee de weg vrij voor verdere wetenschappelijke vooruitgang op het gebied van de chemie.
 Waarom vormen metalen behalve Mg en Mn geen waterstof als ze reageren met salpeterzuur?
Waarom vormen metalen behalve Mg en Mn geen waterstof als ze reageren met salpeterzuur?  Mogelijke nieuwe antivirale middelen tegen COVID-19, herpes
Mogelijke nieuwe antivirale middelen tegen COVID-19, herpes Welk gas ontstaat wanneer nikkel reageert met verdund zwavelzuur?
Welk gas ontstaat wanneer nikkel reageert met verdund zwavelzuur?  Waarom zijn vaste stoffen dichter dan water?
Waarom zijn vaste stoffen dichter dan water?  Opslag van thermische energie:materiaal absorbeert warmte als het smelt en geeft het weer af als het stolt
Opslag van thermische energie:materiaal absorbeert warmte als het smelt en geeft het weer af als het stolt
 Stadsbomen kunnen extreme hitte tot 6 graden verminderen
Stadsbomen kunnen extreme hitte tot 6 graden verminderen Vonnis voor natuurmysterie Nevada, waar uit DNA-tests blijkt dat wolven coyotes waren
Vonnis voor natuurmysterie Nevada, waar uit DNA-tests blijkt dat wolven coyotes waren  De rotskern van Arizona werpt licht op de donkere middeleeuwen uit het Trias
De rotskern van Arizona werpt licht op de donkere middeleeuwen uit het Trias Nieuw project onderzoekt hoe op duurzamere manieren aan de verwachtingen voor bossen kan worden voldaan
Nieuw project onderzoekt hoe op duurzamere manieren aan de verwachtingen voor bossen kan worden voldaan  Wetenschappers op weg om de impact van stedelijk wegstof te ontdekken
Wetenschappers op weg om de impact van stedelijk wegstof te ontdekken
Hoofdlijnen
- Wat is de structuur van een orgaansysteem van een plant?
- Planten die stikstof uit de lucht halen, gedijen goed in droge omgevingen
- Studie biedt een eerste verklaring voor hoe cellen snel hun structuur herstellen en behouden
- Waar worden pseudopodia en flagellum cillia voor gebruikt?
- Waarom zijn er roodharigen? Vogels kunnen de aanwijzingen bevatten
- De chemie van melanine
- Motivaties voor het jagen op dieren in het wild variëren in Afrika en Europa
- Fun Biology Presentatie Onderwerpen
- Groter is beter:de verbeterde neus van mannelijke neusapen is geëvolueerd om partners aan te trekken, zegt onderzoek
- Studie biedt nieuwe inzichten voor technologieën voor het verzamelen van de zon

- Kenniskloof gedicht in ons begrip van degradatie van ethaan
- Guardians of the Ring - Onderzoekers onthullen de structuur van eiwitten die betrokken zijn bij ontstekingsziekten
- De gevoeligheid van COVID-tests meten met nieuw materiaal van NIST
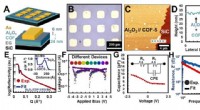
- Onderzoekers helpen de wet van Moore bij te houden door een nieuwe materiaalklasse te verkennen
 Onderzoekers creëren een vloot van robots om door onbekende ondergrondse omgevingen te navigeren
Onderzoekers creëren een vloot van robots om door onbekende ondergrondse omgevingen te navigeren Microsofts anti-hacking-inspanningen maken het een internetagent
Microsofts anti-hacking-inspanningen maken het een internetagent Wat heeft Microsoft nodig in zijn volgende CEO?
Wat heeft Microsoft nodig in zijn volgende CEO?  Bestrijding van uitbraken van ademhalingsvirussen door middel van snelle detectie op basis van nano-popcornsensoren
Bestrijding van uitbraken van ademhalingsvirussen door middel van snelle detectie op basis van nano-popcornsensoren Hoe deep learning de analyse van celbeelden mogelijk maakt
Hoe deep learning de analyse van celbeelden mogelijk maakt  Nieuwe methode voor asymmetrische N, N-acetaalsynthese belooft vooruitgang in de ontwikkeling van geneesmiddelen
Nieuwe methode voor asymmetrische N, N-acetaalsynthese belooft vooruitgang in de ontwikkeling van geneesmiddelen Wat staat voor staal op het periodiek systeem?
Wat staat voor staal op het periodiek systeem?  Aantoonbaarheid van taken een belangrijk onderdeel voor hoe groepen problemen het meest effectief oplossen, studieshows
Aantoonbaarheid van taken een belangrijk onderdeel voor hoe groepen problemen het meest effectief oplossen, studieshows
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

