
Wetenschap
Waarom worden covalente obligaties directionele obligaties genoemd?
De directionaliteit van covalente bindingen is te wijten aan het feit dat de atomaire orbitalen die elkaar overlappen om de bindingen te vormen, specifieke vormen hebben. S-orbitalen zijn bijvoorbeeld bolvormig, p-orbitalen zijn haltervormig en d-orbitalen hebben complexere vormen. Wanneer deze orbitalen elkaar overlappen, vormen ze elektronenparen die geconcentreerd zijn in de overlappende gebieden.
De directionaliteit van covalente bindingen heeft belangrijke gevolgen voor de eigenschappen van moleculen. Het bepaalt bijvoorbeeld de hoeken en lengtes van de bindingen, en het beïnvloedt ook de algehele vorm van het molecuul. De directionaliteit van covalente bindingen is ook essentieel voor het begrijpen van chemische reacties, omdat deze bepaalt hoe atomen zich kunnen binden om nieuwe moleculen te vormen.
Hier zijn enkele voorbeelden van hoe de directionaliteit van covalente bindingen de eigenschappen van moleculen beïnvloedt:
* Hefhoeken: De bindingshoek tussen twee atomen wordt bepaald door de overlap van hun atomaire orbitalen. In een watermolecuul is de H-O-H-bindingshoek bijvoorbeeld 104,5 graden, omdat de p-orbitalen van het zuurstofatoom op een tetraëdrische manier overlappen met de s-orbitalen van de waterstofatomen.
* Bondlengtes: De bindingslengte tussen twee atomen wordt bepaald door de afstand tussen hun atoomkernen. De lengte van de binding wordt beïnvloed door de grootte van de atomen en de sterkte van de binding. De C-C-bindingslengte in ethaan is bijvoorbeeld 1,54 Å, terwijl de C-C-bindingslengte in ethyleen 1,34 Å is. Dit verschil in bindingslengte is te wijten aan het feit dat de C-C-binding in ethaan een enkele binding is, terwijl de C-C-binding in ethyleen een dubbele binding is.
* Moleculaire vorm: De moleculaire vorm van een molecuul wordt bepaald door de rangschikking van zijn atomen en de richting van zijn covalente bindingen. Het watermolecuul is bijvoorbeeld een gebogen molecuul vanwege de tetraëdrische rangschikking van zijn atomen. Het methaanmolecuul is een tetraëdrische molecuul vanwege de tetraëdrische opstelling van de p-orbitalen van het koolstofatoom.
De directionaliteit van covalente bindingen is een fundamentele eigenschap van moleculen die een diepgaande invloed heeft op hun eigenschappen en gedrag.
 Waterstofperoxide-experimenten
Waterstofperoxide-experimenten Snelle screeningmachine kan eiwitsequenties lezen en scheiden
Snelle screeningmachine kan eiwitsequenties lezen en scheiden Nucleatiekinetiek in kaart brengen met nanometerresolutie
Nucleatiekinetiek in kaart brengen met nanometerresolutie Methode voor het maken van optisch actieve polymeren met behulp van een spiraalvormig vloeibaar-kristalsjabloon
Methode voor het maken van optisch actieve polymeren met behulp van een spiraalvormig vloeibaar-kristalsjabloon Onstabiele molecuulklikken met synthetische strategie
Onstabiele molecuulklikken met synthetische strategie
 COVID-19:Stikstofdioxide boven China
COVID-19:Stikstofdioxide boven China Groenland schrapt alle toekomstige olie-exploratie
Groenland schrapt alle toekomstige olie-exploratie Inheemse kennis zou manieren kunnen onthullen om klimaatverandering op eilanden te doorstaan
Inheemse kennis zou manieren kunnen onthullen om klimaatverandering op eilanden te doorstaan Hout vormt de sleutel tot het verminderen van de voedselonzekerheid in Afrika bezuiden de Sahara
Hout vormt de sleutel tot het verminderen van de voedselonzekerheid in Afrika bezuiden de Sahara Floridians kunnen veel frequenter, intense hittegolven
Floridians kunnen veel frequenter, intense hittegolven
Hoofdlijnen
- Wat zijn de meest zichtbare kleuren van een afstand?
- Onderzoek roept op tot een herbestemming van inputsubsidies om duurzame IPM-praktijken te bevorderen
- Vliegenjager heeft 30 nieuwe soorten beschreven
- Wat zijn de functies van glasplaat & dekglaasjes?
- Variabel gif:waarom zijn sommige slangen dodelijker dan andere?
- Hoe Rigor Mortis te onderscheiden van een Cadaveric Spasm
- Er is dringend behoefte aan een oplossing voor een maas in de houtkap in het voorgestelde Great Koala National Park
- Een eiland verkennen dat is binnengevallen door padden en kikkers
- Onderzoek werpt nieuw licht op hoe organismen energie gebruiken in een menigte
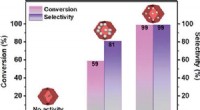
- Een katalytisch systeem van niet-edele metalen voor zeer efficiënte hydrogenering van nitroarenen
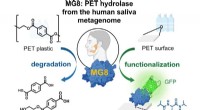
- Enzym in menselijke speekselmicroben breekt plastics op PET-basis af
- Adem in plaats van een bloedtest

- Hoe gebogen oppervlakken in alle vormen uitzetten en samentrekken?

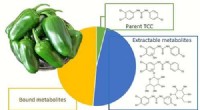
- Peperplant zuigt antibioticum voor persoonlijke verzorging op
 Wat is de chemische formule voor Fructos?
Wat is de chemische formule voor Fructos?  Onderzoek toont een verhaal over twee sociale mediaplatforms voor Donald Trump
Onderzoek toont een verhaal over twee sociale mediaplatforms voor Donald Trump  Nieuw basalttype ontdekt onder de oceaan
Nieuw basalttype ontdekt onder de oceaan Onderzoekers onthullen effecten van stofdeeltjes op wolkeneigenschappen
Onderzoekers onthullen effecten van stofdeeltjes op wolkeneigenschappen Atomen in alle verbindingen worden bij elkaar gehouden door krachten die?
Atomen in alle verbindingen worden bij elkaar gehouden door krachten die?  De hoogste berg in het zonnestelsel is veel hoger dan de Everest
De hoogste berg in het zonnestelsel is veel hoger dan de Everest  Ontwerpen van de volgende generatie haarkleurmiddelen
Ontwerpen van de volgende generatie haarkleurmiddelen Wat is actieve kool en waarom wordt het gebruikt in filters?
Wat is actieve kool en waarom wordt het gebruikt in filters?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

