
Wetenschap
Hoe verschillende metalen vlammen met verschillende kleuren produceren bij verbranding in zuurstof?
Hier zijn de redenen waarom metalen verschillende vlamkleuren vertonen:
1. Elektronische configuratie :De elektronische configuraties van metalen bepalen hun excitatie-energieën. Metalen met losjes gebonden valentie-elektronen (lage ionisatie-energieën) hebben de neiging fotonen met een langere golflengte en lagere energie uit te zenden, wat resulteert in kleuren aan de rode kant van het spectrum. Metalen met nauw gebonden valentie-elektronen (hoge ionisatie-energieën) zenden fotonen met een kortere golflengte en hogere energie uit, waardoor kleuren naar het blauwe of violette uiteinde van het spectrum worden geproduceerd.
2. Atomische structuur en binding :De kristalstructuur, atoomgrootte en bindingseigenschappen van metalen beïnvloeden ook de vlamkleur. De interacties tussen metaalatomen en de omringende zuurstofmoleculen tijdens de verbranding beïnvloeden de energieniveaus en overgangen van de aangeslagen elektronen, wat leidt tot kleurvariaties.
3. Trillings- en rotatie-energieniveaus :Naast elektronische overgangen kunnen de trillingen en rotaties van moleculen in de vlam bijdragen aan de algehele vlamkleur. Verschillende metalen produceren vlammen met verschillende temperaturen, die de mate van trillings- en rotatie-excitaties beïnvloeden, wat resulteert in extra spectrale kenmerken en kleurvariaties.
4. Gedeeltelijke verbranding :Sommige metalen ondergaan een onvolledige verbranding, waarbij slechts gedeeltelijke oxidatie plaatsvindt, wat leidt tot de vorming van verschillende chemische stoffen in de vlam. Deze chemische soorten kunnen hun eigen karakteristieke kleuren uitstralen, wat bijdraagt aan de waargenomen algemene vlamkleur.
5. Onzuiverheden en verontreinigingen :De aanwezigheid van onzuiverheden en verontreinigingen in het metaal of de verbrandingsomgeving kan ook de vlamkleur beïnvloeden. Sporenelementen of verbindingen in het metaal kunnen extra emissielijnen of spectrale banden introduceren, waardoor de waargenomen vlamkleur verandert.
6. Temperatuur :Naarmate de temperatuur van de vlam stijgt, neemt de energie van de uitgezonden fotonen toe, wat resulteert in een verschuiving van de vlamkleur naar het blauwe uiteinde van het spectrum. Hogere temperaturen prikkelen elektronen tot hogere energieniveaus, wat leidt tot de emissie van licht met een kortere golflengte en een hogere energie.
Het is vermeldenswaard dat de waargenomen kleuren niet altijd pure spectrale kleuren zijn, maar kunnen verschijnen als mengsels of combinaties vanwege de aanwezigheid van meerdere emissielijnen en de overlapping van verschillende kleuren. De exacte vlamkleur die door een bepaald metaal wordt geproduceerd, kan variëren afhankelijk van de experimentele omstandigheden, zoals de brandstof-zuurstofverhouding, de temperatuur en de omringende atmosfeer.
 Wat maakt een samengestelde base?
Wat maakt een samengestelde base?  De elegante theorie laat zien hoe water helpt bij het scheiden van ionen die betrokken zijn bij de synthese en productie van materialen
De elegante theorie laat zien hoe water helpt bij het scheiden van ionen die betrokken zijn bij de synthese en productie van materialen  Hoe zuren en basen te bewaren
Hoe zuren en basen te bewaren  Hoe extraheer je benzaldehyde uit olie van bittere amandelen?
Hoe extraheer je benzaldehyde uit olie van bittere amandelen?  Metalen vijfledige ring verlegt de grenzen van aromaticiteit
Metalen vijfledige ring verlegt de grenzen van aromaticiteit
 Hoe de gewone fruitvlieg de zon gebruikt om te navigeren
Hoe de gewone fruitvlieg de zon gebruikt om te navigeren  Zware regenval is geweldig nieuws voor de dammen van Sydney, maar ze komen met een groot voorbehoud
Zware regenval is geweldig nieuws voor de dammen van Sydney, maar ze komen met een groot voorbehoud Scholen in New Delhi gesloten vanwege giftige smog
Scholen in New Delhi gesloten vanwege giftige smog Gletsjer nieuwste Amerikaanse park wordt verschroeid door westerse bosbranden
Gletsjer nieuwste Amerikaanse park wordt verschroeid door westerse bosbranden Kun je zonne-energie opslaan in roest en water?
Kun je zonne-energie opslaan in roest en water?
Hoofdlijnen
- Hoeveel (DNA) schade kan een kankercel verdragen?
- Zijn plantenkernen altijd groter dan dierlijke kernen?
- Wat is de afbraak van sucrase?
- Een nieuwe kijk op toerisme en zijn bijdrage aan natuurbehoud in Nieuw-Zeeland
- Wat is er uniek aan de halogeenfamilie?
- Mieren in het bladerdak van het Amazone-regenwoud hebben veel meer bacteriën in hun ingewanden dan grondbewoners
- Grootte is belangrijk:hoe lichaamsgrootte de verouderingspatronen van honden bepaalt
- Levenscyclus van modder daubers
- Hoe genetica en sociale games de evolutie van paringssystemen bij zoogdieren stimuleren
- Katalytische koppelingen begrijpen:niet alle synergieën zijn eenvoudig
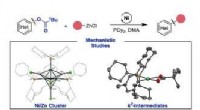
- Totale synthese van flueggenine C via een versnelde intermoleculaire Rauhut-Currier-reactie
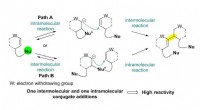
- Ongebruikelijke kobaltverbinding ontwikkeld voor dunnefilmproductie

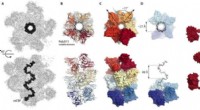
- Wetenschappers maken beelden van antilichamen die samenwerken tegen malaria
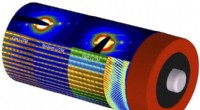
- Batterijmaterialen in kaart brengen met atomaire precisie
 Verschillen van natriumhydroxide versus Natriumcarbonaat
Verschillen van natriumhydroxide versus Natriumcarbonaat  Waarom COVID-19 een les is voor Afrika om sociale bijstand te financieren
Waarom COVID-19 een les is voor Afrika om sociale bijstand te financieren Kan wiskunde de herverdeling eerlijker maken?
Kan wiskunde de herverdeling eerlijker maken?  Is siroop een colloïdale suspensie of homogeen?
Is siroop een colloïdale suspensie of homogeen?  Zwarte fosfor belooft de toekomst van elektronica
Zwarte fosfor belooft de toekomst van elektronica De chemische vingerafdrukken van moleculen in beeld brengen
De chemische vingerafdrukken van moleculen in beeld brengen  Coronavirus:technologie helpt leraren om afstandsonderwijs te heroverwegen
Coronavirus:technologie helpt leraren om afstandsonderwijs te heroverwegen Nanofluidics identificeren epigenetische veranderingen één molecuul tegelijk
Nanofluidics identificeren epigenetische veranderingen één molecuul tegelijk
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

