
Wetenschap
Wat is er uniek aan de halogeenfamilie?
Hoge elektronegativiteit: Halogenen bezitten de hoogste elektronegativiteit van alle elementen in het periodiek systeem. Dit betekent dat ze een sterke neiging hebben om elektronen naar zich toe te trekken. Hun elektronegativiteitswaarden nemen toe in de groep van fluor naar jodium.
Hoog oxidatiepotentieel: Halogenen hebben een hoge ionisatie-energie en een hoge elektronenaffiniteit. Ze accepteren gemakkelijk elektronen, waardoor ze sterke oxidatiemiddelen zijn. Fluor is het krachtigste oxidatiemiddel onder de halogenen en kan bijna alle elementen oxideren.
Diatomische moleculen: Halogenen bestaan als diatomische moleculen, wat betekent dat ze bestaan uit twee aan elkaar gebonden halogeenatomen. De diatomische aard van halogenen is het gevolg van hun hoge elektronegativiteit en de vorming van een stabiele covalente binding.
Kleur: Halogenen vertonen een scala aan kleuren. Fluor is lichtgeel, chloor is groenachtig geel, broom is roodbruin en jodium is violetzwart. Deze kleurvariatie is te wijten aan de verschillen in de absorptie van licht door de halogeenmoleculen.
Reactiviteit met metalen: Halogenen reageren met metalen om metaalhalogeniden te vormen. De reacties zijn doorgaans exotherm en kunnen zelfs explosief zijn, vooral bij zeer reactieve metalen zoals natrium.
Vorming van interhalogeenverbindingen: Halogenen kunnen met elkaar reageren om interhalogeenverbindingen te vormen, die andere eigenschappen hebben dan pure halogenen. Deze verbindingen kunnen bestaan als diatomische moleculen (bijvoorbeeld BrCl) of polyatomaire moleculen (bijvoorbeeld ICl3).
De unieke eigenschappen van halogenen, met name hun hoge reactiviteit en oxiderende kracht, maken ze van cruciaal belang voor diverse industriële toepassingen, waaronder waterzuivering, desinfectie, bleken, fotografie en de productie van verschillende chemische verbindingen.
 Hoe de geheimen van tardigrade levensreddende medicijnen zoals insuline zouden kunnen verbeteren
Hoe de geheimen van tardigrade levensreddende medicijnen zoals insuline zouden kunnen verbeteren  Hoe is smeltwater zout water?
Hoe is smeltwater zout water?  Is een enkele covalente binding sterker dan een dubbele binding?
Is een enkele covalente binding sterker dan een dubbele binding?  Wat is de kleur van het gas dat wordt gevormd door koper en salpeterzuur te combineren?
Wat is de kleur van het gas dat wordt gevormd door koper en salpeterzuur te combineren?  Hoe wordt iridium gewonnen?
Hoe wordt iridium gewonnen?
 Wat zijn twee woorden voor land, water, bossen, planten en mineralen?
Wat zijn twee woorden voor land, water, bossen, planten en mineralen?  Hoe klimaatverandering nieuwe epidemieën aan het licht zou kunnen brengen
Hoe klimaatverandering nieuwe epidemieën aan het licht zou kunnen brengen  Nieuwe technologie voor het opruimen van olievlekken met succes getest
Nieuwe technologie voor het opruimen van olievlekken met succes getest Onderzoeken hoe filmlocaties het toerisme beïnvloeden
Onderzoeken hoe filmlocaties het toerisme beïnvloeden  Op Antartica, toeristen zwemmen tussen pinguïns
Op Antartica, toeristen zwemmen tussen pinguïns
Hoofdlijnen
- Dierenartsen verplegen zieke bobcat, breng het terug naar het park waar het nodig is
- Wat zijn de zes belangrijkste elementen in levende organismen?
- Hoe maak je een werkend hart Model
- Hoe de vlieg vliegt:Wetenschappers ontdekken een genschakelaar die verantwoordelijk is voor de vorming van vliegspieren
- Waarom sommige vuurvliegjes femme fatales worden in hun race om te overleven
- Een nieuwe regulator van de handel in blaasjes in planten
- Stille code van nucleotiden, geen aminozuren, bepaalt functies van vitale eiwitten
- Roots rock:chimpansees drummen op hun eigen kenmerkende beats
- Machine learning kan wetenschappers helpen begrijpen waarom vogels plastic eten
- Het immuunsysteem van planten kan zich aanpassen aan niet-levende omgevingsstressoren, onthult nieuwe studie
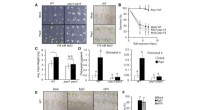
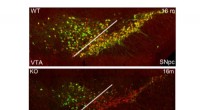
- Epigenetische controle van transcriptionele stabiliteit handhaaft identiteit en functie in dopaminerge en serotonerge neuronen
- Onderzoek onthult hoe klimaatverandering de aquacultuur van Hawaiiaanse visvijvers kan beïnvloeden

- Onderzoeker onthult hoe kevers terugveren van bosbranden

- Mysterieuze nieuwe zeebodemsoorten werpen licht op vroege evolutie van dieren

 Wetenschappers bereiken femtoseconde laserfabricage van magnetisch reagerende Janus-origami-robots
Wetenschappers bereiken femtoseconde laserfabricage van magnetisch reagerende Janus-origami-robots  Kan zonne-energie de bijen redden?
Kan zonne-energie de bijen redden?  Chemici bereiken belangrijke mijlpaal van synthese:chirale inductie op afstand
Chemici bereiken belangrijke mijlpaal van synthese:chirale inductie op afstand University of Houston lanceert eerste nanotech-bedrijf
University of Houston lanceert eerste nanotech-bedrijf Twitter negeert tweets per tekst na hack van CEO-account
Twitter negeert tweets per tekst na hack van CEO-account Zelfverzekerde VW laat rivalen in het stof achter ondanks dieselproblemen
Zelfverzekerde VW laat rivalen in het stof achter ondanks dieselproblemen De grootte van een elektron vergeleken met een atoom en een chromosoom
De grootte van een elektron vergeleken met een atoom en een chromosoom  Welk element vormt geen ion met lading 1?
Welk element vormt geen ion met lading 1?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

