
Wetenschap
Bereken de hoeveelheid ammoniak die wordt geproduceerd uit 50 g N in vergelijking N2+3H2=2NH3?
Mol stikstof (N) =massa/molaire massa
=50g/14g/mol
=3,57 mol N
Laten we nu de stoichiometrie van de gebalanceerde chemische vergelijking analyseren:
1 mol N2 reageert met 3 mol H2 en produceert 2 mol NH3.
Om de beperkende reactant te bepalen, moeten we de molverhouding van N en H2 in de vergelijking vergelijken met de beschikbare molverhouding van N en H2.
Ervan uitgaande dat we een overmatige hoeveelheid waterstof (H2) hebben, laten we dan berekenen hoeveel mol NH3 geproduceerd kan worden uit 3,57 mol N.
Uit de evenwichtige vergelijking:
Uit 1 mol N2 worden 2 mol NH3 geproduceerd.
Dus 3,57 mol N zal (2/1) * 3,57 mol NH3 produceren
=7,14 mol NH3
Nu moeten we het aantal mol NH3 weer omrekenen naar grammen om de geproduceerde hoeveelheid te bepalen. De molmassa van NH3 bedraagt 17 g/mol.
Massa geproduceerde NH3 =Mol NH3 * Molaire massa NH3
=7,14 mol * 17 g/mol
=121,38 gram NH3
Daarom kan 50 g stikstof (N) ongeveer 121,38 g ammoniak (NH3) produceren.
 Wat is meer reatice fluor of chloor?
Wat is meer reatice fluor of chloor?  Waarom neemt de elektronegativiteit afwisselend toe en af in de boorfamilie?
Waarom neemt de elektronegativiteit afwisselend toe en af in de boorfamilie?  Is het waar dat als er een fysieke verandering optreedt wanneer een stof van samenstelling verandert door de vorming van een of meer nieuwe stoffen?
Is het waar dat als er een fysieke verandering optreedt wanneer een stof van samenstelling verandert door de vorming van een of meer nieuwe stoffen?  Onderzoekers kwantificeren thermodynamisch samenspel tijdens co-aggregatie van eiwitten
Onderzoekers kwantificeren thermodynamisch samenspel tijdens co-aggregatie van eiwitten Toppen van waterige golven kunnen essentiële chemicaliën transporteren in een industrieel scheidingsproces
Toppen van waterige golven kunnen essentiële chemicaliën transporteren in een industrieel scheidingsproces
 Een derde van de Chinese stadsbevolking loopt het risico dat de stad zinkt, zo blijkt uit nieuwe satellietgegevens
Een derde van de Chinese stadsbevolking loopt het risico dat de stad zinkt, zo blijkt uit nieuwe satellietgegevens  EU-palmolieverbod zaait bittere zaden voor Zuidoost-Aziatische boeren
EU-palmolieverbod zaait bittere zaden voor Zuidoost-Aziatische boeren Hoe werkt ontzilting?
Hoe werkt ontzilting?  Nieuwe kaarten van zoutgehalte onthullen de impact van klimaatvariabiliteit op oceanen
Nieuwe kaarten van zoutgehalte onthullen de impact van klimaatvariabiliteit op oceanen De effecten van bodemverontreiniging op het milieu
De effecten van bodemverontreiniging op het milieu
Hoofdlijnen
- Hoe meer en meer studenten de burgerwetenschapsbug te pakken krijgen
- De eerste warmbloedige dinosaurussen zijn mogelijk 180 miljoen jaar geleden ontstaan
- De verbazingwekkende diversiteit – en mogelijk verval – van paddenstoelen en andere schimmels
- Genetici ontdekken nieuwe ondersoorten van wilde geiten via oud DNA
- Welk enzym breekt eiwitten af?
- Toen twee ecosystemen met elkaar in botsing kwamen, ontwikkelden ichthyosaurussen het vermogen om grote prooien te consumeren opnieuw
- Een aangepast model dat is ontworpen om kernsplijting te simuleren, werpt licht op hoe geruchten beginnen, zich verspreiden en eindigen
- Slachtoffers van dolfijnen in de Zwarte Zee in de Russische oorlog in Oekraïne
- Helpt een extracellulaire matrix sommige cellen om zich aan aangrenzende cellen te hechten?
- Veelbelovend nieuw pad op zonne-energie voor de productie van waterstofbrandstof

- Een stap dichter bij milieuvriendelijke productie van waterstofbrandstof
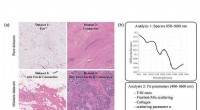
- Bevindingen bevestigen het vermogen van beeldvormende technieken om gezond weefsel te onderscheiden na neoadjuvante chemotherapie
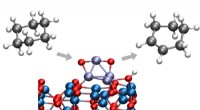
- Wetenschappers pionieren met nieuw chemisch conversieproces bij lage temperatuur
- Nieuw bewijsmateriaal ingediend bij Grenfell Tower Inquiry over bekledingsreactiviteit

 Onderzoekers ontdekken een nieuwe manier waarop ziekten evolueren
Onderzoekers ontdekken een nieuwe manier waarop ziekten evolueren  Wat is osmotische lyse?
Wat is osmotische lyse?  Ruimtewandelaars verliezen stukje afscherming, gebruik in plaats daarvan een patch
Ruimtewandelaars verliezen stukje afscherming, gebruik in plaats daarvan een patch Nieuw onderzoek onthult hoe orkanen het kustlandschap in de Everglades vormgeven
Nieuw onderzoek onthult hoe orkanen het kustlandschap in de Everglades vormgeven Dodelijke superbacteriën vernietigd door moleculaire boren
Dodelijke superbacteriën vernietigd door moleculaire boren Astronomen ontdekken een veranderende blazar
Astronomen ontdekken een veranderende blazar Tientallen satellieten voegen zich bij Vegas rideshare naar de ruimte
Tientallen satellieten voegen zich bij Vegas rideshare naar de ruimte Een vooruitgang in het maken van moleculaire films laat zien hoe moleculen reageren op twee fotonen van licht
Een vooruitgang in het maken van moleculaire films laat zien hoe moleculen reageren op twee fotonen van licht
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

