
Wetenschap
Waarom neemt de elektronegativiteit afwisselend toe en af in de boorfamilie?
1. Atoomstraal: Naarmate we verder naar beneden gaan in de boorfamilie, neemt de atomaire straal van de elementen toe. Dit betekent dat de valentie-elektronen zich verder van de kern bevinden en een zwakkere elektrostatische aantrekkingskracht ervaren. Als gevolg hiervan neemt de elektronegativiteit af.
2. Effectieve nucleaire lading (Zeff): Zeff verwijst naar de netto positieve lading die door de valentie-elektronen wordt ervaren. Het neemt toe naarmate we verder in de groep komen, als gevolg van de toevoeging van meer protonen in de kern. Deze verhoogde Zeff trekt de valentie-elektronen dichter bij de kern, wat resulteert in een hogere elektronegativiteit.
3. Aantal valentie-elektronen: Het aantal valentie-elektronen in de boorfamilie blijft in de hele groep constant op drie. De rangschikking van deze valentie-elektronen verandert echter. In het geval van boor bevinden de drie valentie-elektronen zich in de 2s- en 2p-orbitalen. Naarmate we lager in de groep komen, bezetten de buitenste valentie-elektronen hogere energieniveaus (3s, 3p, enz.). Deze hogere energieniveaus bevinden zich verder van de kern, wat leidt tot een afname van de elektronegativiteit.
Het samenspel tussen de atoomstraal, de effectieve nucleaire lading en de valentie-elektronenconfiguratie resulteert in een afwisselende trend van toenemende en afnemende elektronegativiteit in de boorfamilie. Hier is een samenvatting van de trend:
- Borium (B):Hoge elektronegativiteit vanwege kleine atoomstraal en hoge Zeff.
- Aluminium (Al):Lagere elektronegativiteit dan boor vanwege de grotere atoomstraal.
- Gallium (Ga):hogere elektronegativiteit dan aluminium vanwege verhoogde Zeff.
- Indium (In):Lagere elektronegativiteit dan gallium vanwege de grotere atoomstraal.
- Thallium (Tl):hogere elektronegativiteit dan indium vanwege verhoogde Zeff.
Deze afwisselende trend van elektronegativiteit wordt niet alleen waargenomen in de boorfamilie, maar ook in andere groepen van het periodiek systeem. Het biedt waardevolle inzichten in het chemische gedrag en de eigenschappen van elementen.
 De bossen van Connecticut zijn tegenwoordig ver verwijderd van de torenhoge reuzen van weleer
De bossen van Connecticut zijn tegenwoordig ver verwijderd van de torenhoge reuzen van weleer Kooldioxideniveaus en klimaatverandering:is er echt een controverse?
Kooldioxideniveaus en klimaatverandering:is er echt een controverse? Nieuwe manieren bedenken om plastic uit de oceaan te gebruiken
Nieuwe manieren bedenken om plastic uit de oceaan te gebruiken Minstens 16 gewonden bij vulkaanuitbarsting nabij skigebied Japan
Minstens 16 gewonden bij vulkaanuitbarsting nabij skigebied Japan Wat zijn drie aanpassingen van een zebra?
Wat zijn drie aanpassingen van een zebra?
Hoofdlijnen
- Zijn nieuwe genen altijd beter?
- Artefacten suggereren aankomst van mensen in Australië 18,
- Een titerrapport lezen
- Vogels onthullen het belang van goede buren voor gezondheid en veroudering
- Mieren offeren hun koloniegenoten op als onderdeel van een dodelijke desinfectie
- Zeeschildpadden sterven nadat ze verstrikt zijn geraakt in plastic afval
- Onderzoekers beschrijven hoe cellen het afval buiten zetten om ziekten te voorkomen
- Brigitte Macron viert eerste panda geboren in Frankrijk
- Drie manieren waarop genetische diversiteit optreedt tijdens Meiosis
- Een verwarmer ter grootte van een pil kan de toegankelijkheid bij het diagnosticeren van infectieziekten vergroten

- Identificatie van een nieuwe, schonere bron voor wit licht

- Een woud van nano-paddenstoelenstructuren houdt dit plastic schoon en vlekvrij
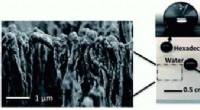
- De leiding nemen om de juiste balans te vinden voor geavanceerde opto-elektronische apparaten

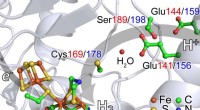
- Nieuwe röntgenspectroscopie onderzoekt waterstofgenererende katalysator
 Wat zijn de fysische en chemische eigenschappen van pizza?
Wat zijn de fysische en chemische eigenschappen van pizza?  Waarom is zintuiglijk belangrijk?
Waarom is zintuiglijk belangrijk?  Intel, Lenovo verspreidde opvouwbare computerkoorts op CES
Intel, Lenovo verspreidde opvouwbare computerkoorts op CES Natuurkundige optimaliseert DNA-microscopietechniek om de beeldsnelheid te verbeteren, kleur toevoegen
Natuurkundige optimaliseert DNA-microscopietechniek om de beeldsnelheid te verbeteren, kleur toevoegen Wat octopus en menselijke hersenen gemeen hebben
Wat octopus en menselijke hersenen gemeen hebben  Studie vindt miljard-jarige superocean-cycli in de geschiedenis van de aarde
Studie vindt miljard-jarige superocean-cycli in de geschiedenis van de aarde Een nieuw oog op de kosmos
Een nieuw oog op de kosmos China plant vooruit voor het leven na steenkool
China plant vooruit voor het leven na steenkool
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

