
Wetenschap
Bepaal de geïdealiseerde bindingshoek voor OF2?
OF2 heeft een centraal zuurstofatoom gebonden aan twee fluoratomen. Het zuurstofatoom heeft zes valentie-elektronen en elk fluoratoom heeft zeven valentie-elektronen.
1) Tel het totale aantal valentie-elektronen:6 (O) + 2(7 F) =20 valentie-elektronen.
2) Bepaal de geometrie van het elektronenpaar:Om deze 20 valentie-elektronen te verdelen, hebben we eerst vier bindingsparen van elektronen nodig (twee voor elke binding) en dan één alleenstaand paar op het zuurstofatoom. Deze vijf elektronenparen zullen een trigonale bipiramidale elektronenpaargeometrie hebben.
3) Bepaal de moleculaire geometrie:De moleculaire geometrie hangt af van de posities van de gebonden atomen en alleenstaande paren. Het eenzame paar op het zuurstofatoom zal een van de equatoriale posities innemen, terwijl de twee fluoratomen axiale posities zullen innemen om de afstoting tussen hen en het eenzame paar te minimaliseren. Dit geeft OF2 een gebogen moleculaire geometrie.
4) Voorspel de geïdealiseerde bindingshoek:De ideale bindingshoek in een trigonale bipiramidale elektronenpaargeometrie is 180 graden. Omdat één eenzaam paar een equatoriale positie inneemt, zal de bindingshoek tussen de fluoratomen worden gecomprimeerd en zal de geïdealiseerde bindingshoek voor OF2 iets minder dan 180 graden zijn. De exacte bindingshoek kan worden bepaald door middel van experimentele metingen of computermethoden en blijkt ongeveer 104 graden te zijn.
 Organische polymere scintillatoren prikkelen de röntgengemeenschap
Organische polymere scintillatoren prikkelen de röntgengemeenschap Waarom wordt azijnzuur toegevoegd voor de titratie van vitamine C?
Waarom wordt azijnzuur toegevoegd voor de titratie van vitamine C?  Wat is de elektronische configuratie van kaliumion?
Wat is de elektronische configuratie van kaliumion?  Wat gebeurt er als vloeistoffen worden blootgesteld aan lucht?
Wat gebeurt er als vloeistoffen worden blootgesteld aan lucht?  Als kalium één elektron in zijn buitenste schil heeft, met welk soort elementen zou het dan het liefst gecombineerd worden?
Als kalium één elektron in zijn buitenste schil heeft, met welk soort elementen zou het dan het liefst gecombineerd worden?
 Hete en droge omstandigheden in het VK veroorzaken ongekend extreem natuurbrandgevaar
Hete en droge omstandigheden in het VK veroorzaken ongekend extreem natuurbrandgevaar Vlees van het menu duwen
Vlees van het menu duwen Nog een reden om door de mens gemaakte ozon te verminderen:om een opwarmende planeet af te koelen
Nog een reden om door de mens gemaakte ozon te verminderen:om een opwarmende planeet af te koelen NASA ziet tropische storm Dora snel verdwijnen
NASA ziet tropische storm Dora snel verdwijnen Studie toont universeel positief effect van bodembedekkers op bodemmicrobioom
Studie toont universeel positief effect van bodembedekkers op bodemmicrobioom
Hoofdlijnen
- Waarom zijn er geen dieren met drie poten?
- Kankercellen gebruiken als logische poorten om te bepalen wat hen beweegt
- Hoe helpt klimaatverandering ziekten te verspreiden?
- Kunnen mensen eeuwig leven?
- Wetenschappers vinden een manier om de negatieve impact van wolluizen op wijngaarden te voorkomen
- Sucrose wordt gevormd wanneer glucose zich verbindt met fructose.
- Wetenschappers krijgen een beter beeld van hoe ooglenseiwitten worden gesorteerd
- Veranderingen in het bladerdak vergemakkelijkten de evolutie van het allereerste glijdende reptiel, suggereert nieuw onderzoek
- Wat wetenschapscommunicatoren zouden kunnen leren van marketingprofessionals
- Onderzoekers ontwikkelen microbellenwasser om gevaarlijke biofilms te vernietigen

- Amorfe diamant gesynthetiseerd

- Wetenschappers ontwerpen nieuwe metabole technologie om wetenschappelijke gegevens voor iedereen te openen

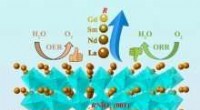
- Afstemming van de elektrokatalytische prestaties van bifunctionele katalysatoren
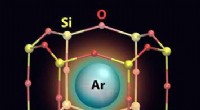
- Bestuderen van argongas gevangen in een tweedimensionale reeks kleine kooien
 Bepaal de volumeverandering die plaatsvindt wanneer een monster van 1,95 liter N2g wordt verwarmd van 250,0 K naar 442,2 K?
Bepaal de volumeverandering die plaatsvindt wanneer een monster van 1,95 liter N2g wordt verwarmd van 250,0 K naar 442,2 K?  Voor studenten van kleur, online racisme leidt tot echte uitdagingen op het gebied van geestelijke gezondheid
Voor studenten van kleur, online racisme leidt tot echte uitdagingen op het gebied van geestelijke gezondheid Werken op afstand verergert de ongelijkheid door vooral mensen met een hoog inkomen te helpen
Werken op afstand verergert de ongelijkheid door vooral mensen met een hoog inkomen te helpen Negatieve exponenten: regels voor vermenigvuldigen en delen
Negatieve exponenten: regels voor vermenigvuldigen en delen  Onderzoekers ontdekken kosmische stofstormen van Type 1a supernova
Onderzoekers ontdekken kosmische stofstormen van Type 1a supernova  Onderzoekers lanceren plasmonen met gecontroleerde hoeveelheden impulsmoment
Onderzoekers lanceren plasmonen met gecontroleerde hoeveelheden impulsmoment Twitter's limiet van 140 tekens:tijd om deze te schrappen?
Twitter's limiet van 140 tekens:tijd om deze te schrappen?  Wanhopige Grieken vluchten als branden het eiland Evia verwoesten
Wanhopige Grieken vluchten als branden het eiland Evia verwoesten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

