Wetenschap
Wetenschappers krijgen een beter beeld van hoe ooglenseiwitten worden gesorteerd
Wetenschappers hebben een beter inzicht gekregen in hoe eiwitten worden gesorteerd in de ooglens, dankzij een nieuwe studie die licht werpt op de moleculaire mechanismen die betrokken zijn bij dit cruciale proces. De bevindingen kunnen implicaties hebben voor het begrijpen en behandelen van cataract, een belangrijke oorzaak van gezichtsverlies wereldwijd.
De ooglens is een transparante, flexibele structuur die zich achter de iris en de pupil bevindt. Het speelt een cruciale rol bij het focusseren van licht op het netvlies, waardoor we op verschillende afstanden duidelijk kunnen zien. De lens bestaat uit gespecialiseerde cellen, lensvezelcellen genaamd, die een hoge concentratie eiwitten bevatten die bekend staan als kristallinen.
Kristallijnen zijn verantwoordelijk voor de transparantie en brekingseigenschappen van de lens. Ze worden gesynthetiseerd in de epitheelcellen van de lens en vervolgens getransporteerd naar de lensvezelcellen, waar ze op een zeer georganiseerde manier worden gerangschikt om een optimale lichttransmissie te garanderen.
Defecten in de sortering en rangschikking van kristallijnen kunnen leiden tot de vorming van cataract, gekenmerkt door een vertroebeling van de lens die het zicht belemmert. Begrijpen hoe de kristallijnen in de lens worden gesorteerd, is daarom essentieel voor het ontwikkelen van effectieve behandelingen voor cataract.
In de nieuwe studie, gepubliceerd in het tijdschrift Nature Communications, gebruikten onderzoekers van de Universiteit van Californië, San Francisco (UCSF) een combinatie van geavanceerde beeldvormingstechnieken en biochemische testen om de moleculaire mechanismen te onderzoeken die ten grondslag liggen aan het sorteren van kristallijnen.
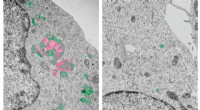
Ze concentreerden zich op een specifiek eiwit genaamd CP49, dat betrokken is bij het transport van kristallijnen van de epitheelcellen van de lens naar de lensvezelcellen. Met behulp van superresolutiemicroscopie visualiseerden de onderzoekers de lokalisatie en dynamiek van CP49 in realtime.
De resultaten onthulden dat CP49 dynamische complexen vormt met kristallijnen en andere eiwitten die betrokken zijn bij intracellulair transport. Deze complexen bewegen zich langs microtubuli, cellulaire structuren die dienen als snelwegen voor intracellulair transport, richting de lensvezelcellen.
Verdere analyse toonde aan dat de interactie tussen CP49 en kristallijnen wordt gereguleerd door een specifieke post-translationele modificatie genaamd fosforylatie. Fosforylering is de toevoeging van een fosfaatgroep aan een eiwit, waardoor de structuur en functie ervan kan veranderen.
De onderzoekers ontdekten dat fosforylering van CP49 door een specifiek enzym, proteïnekinase A (PKA), de interactie tussen CP49 en kristallijnen verbetert, waardoor hun efficiënte transport naar de lensvezelcellen wordt bevorderd.
"Onze studie biedt nieuwe inzichten in de moleculaire mechanismen die de sortering van kristallijnen in de ooglens bepalen", zegt Dr. Michael Bonaguidi, senior auteur van de studie. "Het begrijpen van deze mechanismen zou kunnen leiden tot de ontwikkeling van nieuwe therapeutische strategieën voor cataract en andere lensgerelateerde aandoeningen."
De bevindingen suggereren dat het richten op de CP49-kristallijne interactie of de fosforylatie van CP49 potentiële mogelijkheden zou kunnen zijn voor de behandeling van cataract. Verder onderzoek is nodig om deze mogelijkheden te verkennen en de bevindingen te vertalen naar klinische toepassingen.
 Hoe indigopigment kan worden gebruikt in elektronica
Hoe indigopigment kan worden gebruikt in elektronica Ingenieurs produceren duurzame, energiedichtheid batterij
Ingenieurs produceren duurzame, energiedichtheid batterij Een wondermiddel voor de chemische omzetting van kooldioxide
Een wondermiddel voor de chemische omzetting van kooldioxide Ontgrendel de geheimen van ahornsiroop, molecuul voor molecuul
Ontgrendel de geheimen van ahornsiroop, molecuul voor molecuul Heeft u haast met het ontwikkelen van medicijnen? Hier is je chat
Heeft u haast met het ontwikkelen van medicijnen? Hier is je chat
 Veranderende eetgewoonten om klimaatverandering aan te pakken onbereikbaar voor minderheidsgroepen
Veranderende eetgewoonten om klimaatverandering aan te pakken onbereikbaar voor minderheidsgroepen Landschapsevolutie die inherent is aan oude bergachtige omgevingen
Landschapsevolutie die inherent is aan oude bergachtige omgevingen Het sprookjesachtige boshyacintenbos van België slachtoffer van eigen schoonheid
Het sprookjesachtige boshyacintenbos van België slachtoffer van eigen schoonheid Voorbij sociale netwerken:hoe culturele overtuigingen zich werkelijk verspreiden
Voorbij sociale netwerken:hoe culturele overtuigingen zich werkelijk verspreiden  Sydney stapt af van CBD-model
Sydney stapt af van CBD-model
Hoofdlijnen
- De effecten van straling op dieren
- Inzicht in hoe DNA zichzelf herstelt, kan leiden tot een betere behandeling van kanker
- Houden ze je in de gaten? De kleine hersenen van bijen en wespen kunnen gezichten herkennen
- Waarom ouders in hun beste jaren de beste nakomelingen voortbrengen
- Maken regenachtige dagen je echt down?
- Bloem of vlees? Genetica verklaart de voorkeur van muggen
- Plantaanpassingen: woestijn, tropisch regenwoud, toendra
- Het geheim is bekend:de wereld heeft de Owyhees gevonden. Advocaten zeggen dat het tijd is om het land te beschermen
- Hoe dieren hun juiste grootte bereiken
 Optische levitatie van glazen nanosfeer maakt kwantumcontrole mogelijk
Optische levitatie van glazen nanosfeer maakt kwantumcontrole mogelijk Te midden van pandemie en protesten, Amerikanen weten veel meer over hun rechten
Te midden van pandemie en protesten, Amerikanen weten veel meer over hun rechten Stimulering van plantengroei door hoge CO2 hangt af van fosforhomeostase in chloroplasten
Stimulering van plantengroei door hoge CO2 hangt af van fosforhomeostase in chloroplasten Onderzoek onderzoekt hoe geleidende nanocoatings op textiel kunnen worden aangebracht
Onderzoek onderzoekt hoe geleidende nanocoatings op textiel kunnen worden aangebracht  REBELS-25 is een dynamisch koud schijfstelsel, zo blijkt uit waarnemingen
REBELS-25 is een dynamisch koud schijfstelsel, zo blijkt uit waarnemingen  Het aantal gevangenen in Australië is gedaald, maar wist nog niet precies waarom
Het aantal gevangenen in Australië is gedaald, maar wist nog niet precies waarom De mechanica van door cavitatie veroorzaakt letsel geeft een beter begrip van traumatisch hersenletsel door ontploffing
De mechanica van door cavitatie veroorzaakt letsel geeft een beter begrip van traumatisch hersenletsel door ontploffing Geklede broek optioneel:hoe retailers omgaan met veranderende consumentengewoonten
Geklede broek optioneel:hoe retailers omgaan met veranderende consumentengewoonten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com