
Wetenschap
Amorfe diamant gesynthetiseerd
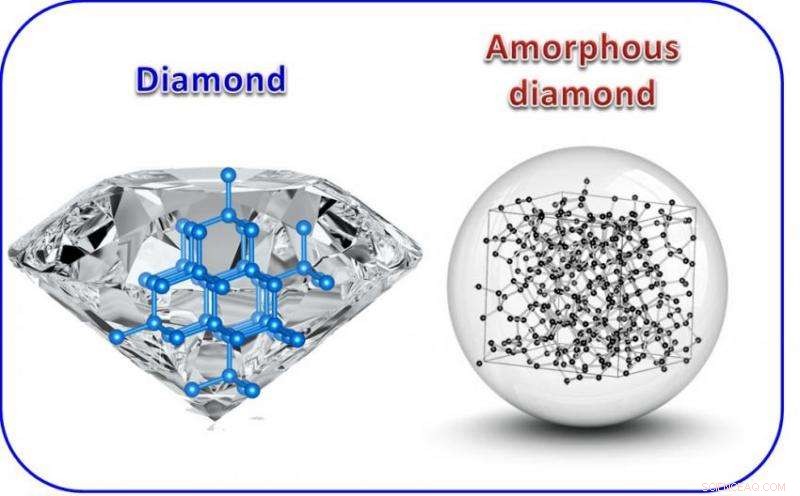
Atomaire structuur van diamant (links) vergeleken met amorfe diamant (rechts). Diamant is kristallijn en anisotroop, wat betekent dat de eigenschappen gericht zijn. De enkele kristallijne diamant in de linker afbeelding bevat veel facetten. In tegenstelling tot, amorfe diamant is isotroop zoals glas, en het kan in elke vorm worden gesneden, inclusief een ideale bol. Krediet:Zhidan "Denise" Zeng
Een team van Carnegie hogedrukfysici heeft een vorm van koolstof gecreëerd die zo hard is als diamant, maar amorf, wat betekent dat het de grootschalige structurele herhaling van de kristallijne structuur van een diamant mist. Hun bevindingen worden gerapporteerd in Natuurcommunicatie .
Koolstof is een element van schijnbaar oneindige mogelijkheden, omdat de configuratie van zijn elektronen talrijke zelfbindende combinaties mogelijk maakt die aanleiding geven tot een reeks materialen met verschillende eigenschappen.
Bijvoorbeeld, sommige vormen van koolstof, zoals kolen, zijn wat amorf wordt genoemd, wat betekent dat ze de repetitieve structuur op lange afstand missen waaruit een kristal bestaat.
Andere vormen van koolstof zijn kristallijn, inclusief zowel transparant, superharde diamanten, en zacht, ondoorzichtig grafiet. Ze hebben verschillende eigenschappen, gedeeltelijk, omdat de koolstofatomen waaruit ze bestaan, in verschillende configuraties zijn gebonden. Diamanten hebben een bindingsstructuur die sp3 wordt genoemd en de koolstof in grafiet wordt bij elkaar gehouden met zogenaamde sp2-bindingen.
Veranderingen in de configuratie van de koolstofbindingen die een van deze stoffen vormen, kunnen worden veroorzaakt door externe omstandigheden te veranderen, zoals temperatuur en druk, vergelijkbaar met hoe water bevriest tot ijs of kookt tot stoom.
Het Carnegie-team, inclusief hoofdauteur Zhidan "Denise" Zeng, evenals Liuxiang Yang, Qiaoshi Zeng, Yue Meng, Wenge Yang, en Ho-kwang "Dave" Mao - gebruikten extreme druk om hun nieuwe vorm van amorfe diamant te ontdekken.
Andere soortgelijke elementen als koolstof - germanium en silicium - hebben vormen die volledig bestaan uit extreem sterke sp3-bindingen en toch amorf zijn. Maar tot nu toe, een vergelijkbare fase van koolstof was nog nooit gesynthetiseerd.
Het team was in staat om amorfe diamant te creëren door een structureel ongeordende vorm van koolstof genaamd glasachtige koolstof tot bijna 500 te brengen, 000 keer de normale atmosferische druk (50 gigapascal) en ongeveer 2, 780 graden Fahrenheit (1, 800 graden kelvin). Dit is een temperatuur- en drukbereik dat niet is onderzocht in de pogingen om amorfe diamant te creëren.
Het monster dat ze creëerden behield zijn structurele verandering en onsamendrukbaarheid nadat het was teruggebracht tot omgevingstemperatuur en -druk. Bovendien, geavanceerde spectroscopie-instrumenten toonden aan dat hun nieuwe materiaal sp3-koolstofbindingen bevat, ondanks dat het amorf is en de orde van een kristal mist.
"Onze amorfe diamant is dicht, transparant, supersterk en potentieel superhard met nog meer ongelooflijke eigenschappen die nog ontdekt moeten worden, ’ legde Zeng uit.
De volgende stappen voor het onderzoeken van de eigenschappen van deze amorfe diamant zijn het meten van de hardheid, kracht, optische eigenschappen, en thermische stabiliteit.
 Onthulling van de nauwkeurigheid van tsunami-voorspellingen
Onthulling van de nauwkeurigheid van tsunami-voorspellingen Nieuw juni-record voor ontbossing Braziliaanse Amazone
Nieuw juni-record voor ontbossing Braziliaanse Amazone Koolstofvastlegging in oceanen aangedreven door fragmentatie van grote organische deeltjes
Koolstofvastlegging in oceanen aangedreven door fragmentatie van grote organische deeltjes World Wetlands Day:wereldwijde biodiversiteit bevorderen en klimaatverandering tegengaan
World Wetlands Day:wereldwijde biodiversiteit bevorderen en klimaatverandering tegengaan Na Eta en Iota, NASA helpt Midden-Amerika voorbereiden op toekomstige stormen
Na Eta en Iota, NASA helpt Midden-Amerika voorbereiden op toekomstige stormen
Hoofdlijnen
- Studie suggereert nieuwe doelen voor het verbeteren van het sojaoliegehalte
- Hoop op een van 's werelds zeldzaamste primaten:eerste telling van Zanzibar Red Colobus-aap
- Waar komt de kleur vandaan in paarse kool?
- Difference Between Triglycerides & Phospholipids
- Hoe maak je een modelhart met materialen uit je thuis
- Dansgerelateerde wetenschapsprojecten
- Haaien spotten drones op patrouille op Australische stranden
- Levensduur verlengd door remming van gemeenschappelijk enzym
- Hoe erg is zwarte schimmel,
- Een nieuwe draai aan de oorsprong van het leven?

- Gouden nanodeeltjes om toepassingen te vinden in de waterstofeconomie

- Reactieresultaten voorspellen:machines leren scheikunde

- Onderzoekers ontwikkelen zich snel, efficiënte manier om aminozuurketens te bouwen

- Synthese van UV-absorbers uit cashewnotenschilvloeistof

 Afbeelding:Jupiter-antenne die uit de kou kwam
Afbeelding:Jupiter-antenne die uit de kou kwam In de ruimte gebaseerde infraroodbeeldvorming onthult het nachtelijke weer op Venus
In de ruimte gebaseerde infraroodbeeldvorming onthult het nachtelijke weer op Venus Wetenschappers ontdekten door tip geïnduceerde onconventionele supergeleiding op Weyl-halfmetalen
Wetenschappers ontdekten door tip geïnduceerde onconventionele supergeleiding op Weyl-halfmetalen Berekening van relatieve standaardfout
Berekening van relatieve standaardfout  Grootte van witrotschimmels verklaard door de breedte van de betrokken genfamilies
Grootte van witrotschimmels verklaard door de breedte van de betrokken genfamilies Nieuw chemisch proces een eerste stap naar het maken van nucleaire brandstof met vuur
Nieuw chemisch proces een eerste stap naar het maken van nucleaire brandstof met vuur Dagelijkse computeronderdelen aan een stralingstest in de ruimte onderwerpen
Dagelijkse computeronderdelen aan een stralingstest in de ruimte onderwerpen Het ultieme in alle terreinen
Het ultieme in alle terreinen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

