
Wetenschap
Hoe zijn waterstofnatrium en rubidium vergelijkbaar?
1. Alkalimetalen:
- Waterstof, natrium en rubidium zijn allemaal alkalimetalen. Dit betekent dat ze tot groep 1 van het periodiek systeem behoren.
2. Zeer reactief:
- Alkalimetalen staan bekend om hun hoge reactiviteit. Ze verliezen gemakkelijk hun buitenste elektron (valentie-elektron) om positieve ionen (kationen) te vormen. Deze hoge reactiviteit is te danken aan hun lage ionisatie-energie.
3. Vorming van basische oxiden en hydroxiden:
- Wanneer alkalimetalen reageren met zuurstof, vormen ze basische oxiden (bijvoorbeeld Na2O, Rb2O). Op dezelfde manier vormen ze, wanneer ze met water reageren, sterk basische hydroxiden (bijvoorbeeld NaOH, RbOH).
4. Lage ionisatie-energie:
- Alkalimetalen hebben lage ionisatie-energieën omdat het valentie-elektron losjes aan de kern is gebonden. Hierdoor kunnen ze dit elektron gemakkelijk verliezen, wat resulteert in de vorming van positief geladen ionen.
5. Glanzend en zilverachtig uiterlijk:
- Waterstof, natrium en rubidium hebben allemaal een glanzend en zilverachtig uiterlijk vanwege hun metaalachtige aard.
6. Goede geleiders van elektriciteit en warmte:
- Alkalimetalen zijn uitstekende geleiders van elektriciteit en warmte. Deze eigenschap is het resultaat van hun losjes gebonden valentie-elektronen, die vrij kunnen bewegen binnen het kristalrooster van het metaal.
Het is belangrijk op te merken dat hoewel waterstof, natrium en rubidium deze overeenkomsten delen als alkalimetalen, ze ook unieke eigenschappen en kenmerken vertonen die hen van elkaar onderscheiden.
 Is waterstofsulfide een covalente of ionische verbinding?
Is waterstofsulfide een covalente of ionische verbinding?  Thermische oorkappen beschermen de batterijen van mobiele telefoons tegen extreme temperaturen
Thermische oorkappen beschermen de batterijen van mobiele telefoons tegen extreme temperaturen Wat gebeurt er met de pH van water als HCI wordt toegevoegd?
Wat gebeurt er met de pH van water als HCI wordt toegevoegd?  De chemische evolutie van DNA en RNA op de vroege aarde
De chemische evolutie van DNA en RNA op de vroege aarde Is de vertering van voedsel fysieke verandering of chemische verandering?
Is de vertering van voedsel fysieke verandering of chemische verandering?
Hoofdlijnen
- Eiwitten in haaientanden kunnen duiden op wat ze eten
- Verlegen mannelijke albatrossen verkiezen echtscheiding boven confrontatie:studie
- De variabiliteit van het dagelijks leven heeft mogelijk minstens evenveel invloed op de evolutie gehad als zeldzame activiteiten zoals de jacht op groot wild
- Nieuwe inzichten over hoe de vogelgriep de soortbarrière overschrijdt
- Het veranderen van de inheemse vegetatiewetten om verbranding op privéterrein mogelijk te maken, is een goed brandbeheer, zeggen Australische onderzoekers
- Honingbijen stemmen om te beslissen over nestplaatsen – waarom we zouden moeten luisteren
- Waarom tussenzaaien de boost kan zijn die bodembedekkers nodig hebben
- Met software kunnen onderzoekers kleine ronde voorwerpen uit DNA maken. Dit is waarom dat cool is
- Bootverkeer bedreigt het voortbestaan van de Bocas Del Toro-dolfijnen in Panama
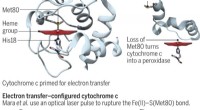
- Energetische kosten van de entatische toestand van cytochroom c gekwantificeerd
- Neutronen vangen vormveranderend coronavirus-eiwitcomplex op heterdaad
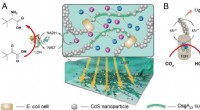
- Bacteriële biofilms vergemakkelijken biocompatibele bio-abiotische interfaces voor semi-kunstmatige fotosynthese
- Snuffelen welke plantaardige burgers het meest naar echt rundvlees ruiken

- De stijfste poreuze lichtgewicht materialen ooit

 Wat zijn functies van eiwitten?
Wat zijn functies van eiwitten?  Onderzoeker ontwikkelt een chatbot met expertise in nanomaterialen
Onderzoeker ontwikkelt een chatbot met expertise in nanomaterialen  Zijn we wijzer over tsunami's? Deskundige zegt ja en nee
Zijn we wijzer over tsunami's? Deskundige zegt ja en nee  Zandkastelen en verrassende oorsprong van basale cellulaire functies
Zandkastelen en verrassende oorsprong van basale cellulaire functies Rustige storing in Brits-Columbia die grote aardbevingen kan veroorzaken
Rustige storing in Brits-Columbia die grote aardbevingen kan veroorzaken Bepaling van de parameters voor transmissie-elektronenmicroscopie
Bepaling van de parameters voor transmissie-elektronenmicroscopie EU heroverweegt hulp voor civiele bescherming na branden in Portugal
EU heroverweegt hulp voor civiele bescherming na branden in Portugal Van zee tot stralende zee:nieuw onderzoek onthult meningen op staatsniveau over klimaatverandering
Van zee tot stralende zee:nieuw onderzoek onthult meningen op staatsniveau over klimaatverandering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

