
Wetenschap
Waarom wordt zwaveligzuur als een zwak terwijl zwavelachtig sterk zuur beschouwd?
Zwavelzuur (H2SO4) is een sterk zuur omdat het volledig dissocieert in water, waarbij twee H+ ionen per molecuul vrijkomen:
H2SO4 → 2H+ + SO42-
Dit betekent dat alle H+-ionen uit zwavelzuur beschikbaar zijn om met andere stoffen te reageren, waardoor het een zeer sterk zuur wordt.
Zwavelzuur (H2SO3) , aan de andere kant, is een zwak zuur omdat het slechts gedeeltelijk dissocieert in water, waarbij één H+ ion per molecuul vrijkomt:
H2SO3 → H+ + HSO3-
Dit betekent dat slechts een klein deel van de H+-ionen uit zwavelzuur beschikbaar is om te reageren met andere stoffen, waardoor het een zwak zuur wordt.
Het verschil in zuurgraad tussen zwavelzuur en zwaveligzuur is te wijten aan de aanwezigheid van het tweede zuurstofatoom in zwavelzuur. Dit extra zuurstofatoom helpt de negatieve lading op het sulfaation (SO42-) te stabiliseren, waardoor het moeilijker wordt voor de H+-ionen om vrij te komen. Als gevolg hiervan is zwavelzuur een veel sterker zuur dan zwavelig zuur.
 Meer inwoners vluchten als branden West-Canada teisteren
Meer inwoners vluchten als branden West-Canada teisteren Het noordpoolgebied is meedogenloos; rijden in deze ijsbreker is niet
Het noordpoolgebied is meedogenloos; rijden in deze ijsbreker is niet Wat voor soort huis zou de boom bieden?
Wat voor soort huis zou de boom bieden?  De vitale functies van de wereldwijde oceaan opnemen met biogeochemische drijvers
De vitale functies van de wereldwijde oceaan opnemen met biogeochemische drijvers IJsstroom die de Groenlandse ijskap droogt, gevoelig voor veranderingen in de afgelopen 45 jaar, 000 jaar
IJsstroom die de Groenlandse ijskap droogt, gevoelig voor veranderingen in de afgelopen 45 jaar, 000 jaar
Hoofdlijnen
- Chronische verspillende ziekte:de problemen met de prionziekte van hertachtigen aanpakken
- Wat maakt een leider? Aanwijzingen uit het dierenrijk
- Onderzoekers tonen aan dat de lengte van telomeren de levensverwachting in het wild voorspellen
- Octopussen gestrand op het strand van Wales - hier zijn de wetenschappelijke theorieën waarom
- Wat is het verschil tussen een microbe en een schimmel?
- Oud DNA onthult kinderen met het syndroom van Down in vroegere samenlevingen. Wat kunnen hun begrafenissen ons vertellen over levens?
- Waar in de cel bevindt zich mRNA?
- De wilde dieren in Mongolië lopen gevaar door overbegrazing
- Welk proces gebruiken cellen als ze niet genoeg zuurstof hebben voor de ademhaling?
- Op schelpen geïnspireerde suikerschild beschermt materialen in vijandige omgevingen

- De geur van pure chocolade, gedemystificeerd
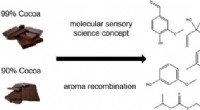
- Nucleatie een zegen voor duurzame nanofabricage

- Een vereenvoudigd nieuw proces zet houtafval uit landbouw en bosbeheer om in ethanol

- Wetenschappers stellen methode voor om de efficiëntie van zonnebatterijen te verhogen
 Miniatuurorganismen in het zand spelen grote rol in onze oceaan
Miniatuurorganismen in het zand spelen grote rol in onze oceaan Federale uitgaven voor vuursubsidies kunnen evenwichtiger zijn, nieuw model suggereert:
Federale uitgaven voor vuursubsidies kunnen evenwichtiger zijn, nieuw model suggereert: Warme nachten:VS in juli vestigt nieuw record voor nachtelijke warmte
Warme nachten:VS in juli vestigt nieuw record voor nachtelijke warmte Zijn de inheemse duiven van Australië eenden?
Zijn de inheemse duiven van Australië eenden?  Hoe reageren bacteriën?
Hoe reageren bacteriën?  Vuur in de ruimte-experiment begint aan boord van Amerikaans vrachtschip (update)
Vuur in de ruimte-experiment begint aan boord van Amerikaans vrachtschip (update) Uit onderzoek blijkt dat dezelfde voedingsmiddelen een duidelijk verschillende impact op het milieu hebben
Uit onderzoek blijkt dat dezelfde voedingsmiddelen een duidelijk verschillende impact op het milieu hebben  Wat is de reactie van fosforzuur met salpeterzuur?
Wat is de reactie van fosforzuur met salpeterzuur?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

