Wetenschap
Chemici laten zien dat het katalytische bereik van enzymen kan worden vergroot
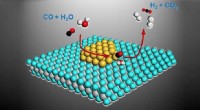
Enzymen zijn eiwitmoleculen die chemische reacties in levende organismen katalyseren. Ze zijn zeer selectief en efficiënt, waardoor complexe reacties onder milde reactieomstandigheden kunnen plaatsvinden. De substraatomvang van enzymen is echter vaak beperkt, wat betekent dat ze slechts een beperkt aantal reacties kunnen katalyseren.
"Het vergroten van het katalytische repertoire van enzymen is een al lang bestaand doel in de chemie en biotechnologie", zegt Tobias Erb, hoogleraar chemische biologie en genetica bij JGU. "Dit zou ons in staat stellen enzymen te gebruiken voor een breder scala aan synthetische reacties en mogelijk nieuwe biokatalytische processen te ontwikkelen voor de productie van farmaceutische producten en andere fijne chemicaliën."
Eén manier om het substraatbereik van enzymen uit te breiden is door ze te manipuleren door mutaties of chemische modificaties te introduceren. Deze aanpak is echter vaak vervelend en tijdrovend, en het kan moeilijk zijn om te voorspellen welke wijzigingen tot de gewenste katalytische activiteit zullen leiden.
"We wilden een meer algemene strategie ontwikkelen die ons in staat zou stellen het katalytische bereik van enzymen op een rationele en efficiënte manier te vergroten", legt Christopher Gregg uit, een postdoctoraal onderzoeker in de groep van Erb. "We werden geïnspireerd door het feit dat veel enzymen metaalionen bevatten die essentieel zijn voor hun katalytische activiteit."
De onderzoekers veronderstelden dat ze door het introduceren van een metaalbindingsplaats in een bestaand enzymscaffold een kunstmatig metallo-enzym zouden kunnen creëren met een nieuwe katalytische activiteit. Om deze hypothese te testen, fuseerden ze een rationeel ontworpen zinkbindingsplaats met een enzymscaffold afgeleid van het enzym chorismaatmutase.
"We waren blij toen we ontdekten dat het fusie-eiwit een ongekende katalytische promiscuïteit vertoonde", zegt Gregg. "Het was in staat om de cycloadditie van aziridines met kooldioxide te katalyseren om oxazolidinonen op te leveren - een reactie die tot nu toe niet in de natuur is waargenomen."
De onderzoekers denken dat hun strategie ook kan worden gebruikt om het katalytische bereik van andere enzymen te vergroten. "We werken momenteel aan het uitbreiden van de reikwijdte van ons kunstmatige metallo-enzym naar andere soorten reacties", zegt Erb. "We onderzoeken ook het gebruik van andere metaalionen en enzymen."
De studie, die op 20 februari 2023 in Nature Chemistry werd gepubliceerd, opent nieuwe mogelijkheden voor het ontwerp van biokatalytische processen. Door het katalytische bereik van enzymen uit te breiden, kan het mogelijk zijn om efficiëntere en milieuvriendelijkere methoden te ontwikkelen voor de productie van een verscheidenheid aan chemicaliën.
 Licht biedt controle voor 3D-printen met meerdere materialen
Licht biedt controle voor 3D-printen met meerdere materialen Hoe nieuwe materialen de efficiëntie van directe ethanolbrandstofcellen verhogen
Hoe nieuwe materialen de efficiëntie van directe ethanolbrandstofcellen verhogen Nieuwe studie onderzoekt de passage van geknoopt DNA door nanoporiën
Nieuwe studie onderzoekt de passage van geknoopt DNA door nanoporiën Microbiële productie van een natuurlijke rode kleurstof karmijnzuur
Microbiële productie van een natuurlijke rode kleurstof karmijnzuur Chemici ontwikkelen nieuwe blauwdruk voor enzym betrokken bij kanker
Chemici ontwikkelen nieuwe blauwdruk voor enzym betrokken bij kanker
 Australische kolen gebruiken een existentiële bedreiging voor eilanden:Fiji PM
Australische kolen gebruiken een existentiële bedreiging voor eilanden:Fiji PM Hoe wordt vegetarisch behouden Algehele energie in trofische niveaus?
Hoe wordt vegetarisch behouden Algehele energie in trofische niveaus?  Niet-levende beperkende factoren in de Grassland
Niet-levende beperkende factoren in de Grassland NASA's Aqua-satelliet onthult dissipatie van tropische cycloon Esamis
NASA's Aqua-satelliet onthult dissipatie van tropische cycloon Esamis NASA's Terra-satelliet gluurt naar het 60-mijls brede oog van Super Typhoon Trami
NASA's Terra-satelliet gluurt naar het 60-mijls brede oog van Super Typhoon Trami
Hoofdlijnen
- Nieuwe 'atlas' brengt in kaart hoe antilichamen spike-eiwitvarianten aanvallen
- Nieuwe vooruitgang in de biologische fixatie van stikstof in rijst
- Hoe bacteriën met zout te doden
- Nieuw onderzoek onthult aanwijzingen over hoe antilichamen verfijnd worden om infecties te bestrijden
- Microbioomtransplantaties bieden ziekteresistentie in ernstig bedreigde Hawaiiaanse plant
- We volgen de voetstappen van het Noord-Chinese luipaard
- Onderzoekers lokaliseren genetische mutatie bij chronische nachtbrakers
- Een mogelijke verklaring voor hoe kiemlijnen worden verjongd
- Denk je dat krekels raar zijn? Kijk eens naar superfans, die de insecten opeten, gebruiken in de kunst en zelfs striptease
 Klimaatverandering heeft de productiviteit van de voedselketens in de schappen van de schappen verlaagd
Klimaatverandering heeft de productiviteit van de voedselketens in de schappen van de schappen verlaagd Een 20 procent markup
Een 20 procent markup Wat is het verschil tussen een Stun Gun & Taser?
Wat is het verschil tussen een Stun Gun & Taser?
Veel mensen gebruiken de term 'taser' en 'stun gun' uitwisselbaar, maar er zijn aanzienlijke verschillen tussen de twee. De ene is ontworpen om op afstand te worden gebruikt, terwijl de andere alleen
 Statistische gevolgtrekking om de werkwijze van een zeer ervaren kristallograaf na te bootsen
Statistische gevolgtrekking om de werkwijze van een zeer ervaren kristallograaf na te bootsen Draagbaar AI-apparaat zet hoestgeluiden om in gezondheidsgegevens voor prognoses van griep en pandemie
Draagbaar AI-apparaat zet hoestgeluiden om in gezondheidsgegevens voor prognoses van griep en pandemie VS moeten opties voor thuiskoeling overwegen tijdens pandemie
VS moeten opties voor thuiskoeling overwegen tijdens pandemie E-scooters worden razend populair, maar we moeten rekening houden met het weer
E-scooters worden razend populair, maar we moeten rekening houden met het weer Onderzoekers blijven de productie van grafeen verfijnen met HPC
Onderzoekers blijven de productie van grafeen verfijnen met HPC
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com