
Wetenschap
Chemici ontwikkelen nieuwe blauwdruk voor enzym betrokken bij kanker
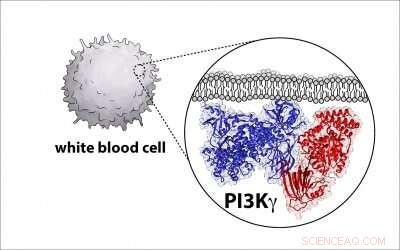
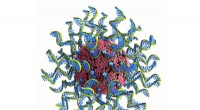
Krediet:Universiteit van Oregon
Wetenschappers weten al tientallen jaren dat een bepaalde klasse enzymen een belangrijke speler is in de celbiologie, omdat ze vaak muteren en belangrijke aanjagers van kanker worden.
Biofarmaceutische bedrijven proberen medicijnen te ontwikkelen die deze enzymen aanspreken en inactiveren. bekend als fosfoinositide 3-kinase, of kortweg PI3K, vanwege hun rol bij het veroorzaken van kanker bij mensen. Maar om dat te doen, wetenschappers hebben een gedetailleerde blauwdruk nodig van de enzymarchitectuur, en UO-professor biochemie Scott Hansen maakt deel uit van een groep die dat diagram blootlegt.
Hans, een assistent-professor bij de UO-afdeling Chemie en Biochemie, een deel van de uitdaging is dat de moleculen complex zijn, met twee grote eiwitten die samenkomen en een complex vormen.
"Dus het is een hele uitdaging om erachter te komen wat de structuur en organisatie van dit eiwit is, " zei hij. "Een voorwaarde voor het ontwikkelen van een medicijn is leren hoe het medicijn zich aan het molecuul bindt. Je hebt een blauwdruk van het eiwit nodig om dat medicijn aan vast te maken."
Nu hebben Hansen en collega's van verschillende andere universiteiten zo'n blauwdruk voor PI3K ontwikkeld en geïdentificeerd waar een kritisch regulerend eiwit aan het enzym bindt, een bevinding met potentieel om de inspanning om meer specifieke kankerdrugs te bouwen te helpen opvoeren.
"Dit zal zeker bepalen hoe mensen denken over het ontwikkelen van kankertherapieën, " hij zei.
Hansen is een van de 13 co-auteurs van het artikel dat in het tijdschrift is gepubliceerd wetenschappelijke vooruitgang , samen met collega's aan de universiteiten van Victoria, Brits Colombia, Washington en Genève, en Vrije Universiteit Brussel in België.
Wat het document uniek maakt, is "structurele informatie met een hogere resolutie en het kunnen meten van biologisch relevante interacties met andere moleculen bij het bepalen van de volgorde en prioriteit van interacties, ' zei Hansen.
Maar hij zei dat er nog veel werk moet worden verzet om beter te begrijpen hoe andere moleculen aan het eiwit binden en de functie ervan moduleren.
Om de structuur van het enzym te leren, de onderzoekers gebruikten een techniek genaamd cryo-elektronenmicroscopie, die tienduizenden beelden van enkele P13K-enzymen verzamelt in een ultradun laagje ijs met behulp van een elektronenmicroscoop. De afbeeldingen worden gecompileerd en gemiddeld om een enkel beeld met hoge resolutie te creëren dat de structurele kenmerken van het enzym onthult.
In dit geval, de structuur van het enzym was anders dan eerder werd gedacht. Met de nieuwe blauwdruk kunnen onderzoekers bepalen hoe andere moleculen het eiwit activeren.
"Vaak doen we onderzoek en krijgen we aanwijzingen over hoe eiwitten zijn georganiseerd of we kijken naar structuren van verwante moleculen en extrapoleren, maar soms zijn die aannames onnauwkeurig en kunnen ze een veld op het verkeerde pad brengen, "Zei Hansen. "Door een blauwdruk met een hogere resolutie van de organisatie van moleculen te hebben, kunnen mensen medicijnen ontwikkelen die specifiek zijn voor alleen die molecule."
Hansen zei dat onderzoekers die betrokken zijn bij de paper 10 jaar aan het probleem hebben gewerkt.
"Dat is niet ongebruikelijk voor echt gecompliceerde eiwitten, " hij zei.
Hansen zei dat zijn laboratorium aan de UO en het laboratorium van John Burke aan de Universiteit van British Columbia complementair onderzoek doen. Burke's lab gebruikt cryo-elektronenmicroscopie om hoge resolutie beelden van moleculen te krijgen, en het lab van Hansen is in staat om "meer dynamische maatregelen te nemen waarmee we de interacties van dit enzym en andere factoren die cruciaal zijn voor activering kunnen meten."
Hij zei dat het opwindend is om samen te werken met andere wetenschappers die expertise hebben op gebieden die hij niet heeft.
"Meer en meer, om onze onderzoeksambities te verwezenlijken, kunnen we niet alleen vertrouwen op de vaardigheden in ons eigen lab, " zei hij. "Problemen worden te ingewikkeld en je moet ze vanuit verschillende invalshoeken benaderen en veel verschillende expertise integreren."
 Fotoexpansie:Biobased polyesters harde film
Fotoexpansie:Biobased polyesters harde film Niet zo fantastisch plastic voor eenmalig gebruik om een milieuvriendelijke make-over te krijgen
Niet zo fantastisch plastic voor eenmalig gebruik om een milieuvriendelijke make-over te krijgen EHBO-kit in sommige levende organismen helpt bij het repareren van DNA na langdurige blootstelling aan de zon
EHBO-kit in sommige levende organismen helpt bij het repareren van DNA na langdurige blootstelling aan de zon Een stroomdiagram voor biologie maken
Een stroomdiagram voor biologie maken De toekomst van elektronica is rekbaar
De toekomst van elektronica is rekbaar
 Toen en nu:hoe gletsjers over de hele wereld smelten
Toen en nu:hoe gletsjers over de hele wereld smelten Onderzoek onderzoekt hoe insectenuitbraken bossen en vleermuizen aantasten
Onderzoek onderzoekt hoe insectenuitbraken bossen en vleermuizen aantasten Grotgeheimen ontgrendeld om patronen van droogte en regen uit het verleden te tonen
Grotgeheimen ontgrendeld om patronen van droogte en regen uit het verleden te tonen Onderzoek bepaalt de redenen voor enorme branden in het zuiden van centraal Chili
Onderzoek bepaalt de redenen voor enorme branden in het zuiden van centraal Chili Studie:Droogte neemt toe in Europa
Studie:Droogte neemt toe in Europa
Hoofdlijnen
- Grootste genetische studie van muggen onthult verspreiding van resistentie tegen insecticiden in Afrika
- Een biobank van omkeerbare mutante embryonale stamcellen
- Zouttolerante planten kweken
- Grafische Australische video van Japanse walvisvangst vrijgegeven
- De voordelen van over jezelf praten in de derde persoon
- Eksters kunnen vriendschappen sluiten met mensen - dit is hoe
- Genezing van verbrande poten met vissenhuid
- eDNA gebruiken om de broedhabitat van bedreigde diersoorten te identificeren
- De soorten elektroforese
- Titaniumcarbidevlokken verkregen door selectief etsen van titaniumsiliciumcarbide
- Hoe het volume van een Atom
- Laserverdampingstechnologie om nieuwe zonnematerialen te creëren

- Chemicaliën kunnen hun identiteit veranderen, dankzij de vloeistoffen waar ze zich bevinden
- Nieuwe machine learning-techniek analyseert snel nanomedicijnen voor immunotherapie bij kanker
 Er zijn dingen:blijvende mysteries volgen Amerikaans rapport over UFO's
Er zijn dingen:blijvende mysteries volgen Amerikaans rapport over UFO's Yale speelt kwantumvangst in nieuw onderzoek
Yale speelt kwantumvangst in nieuw onderzoek Waveguide-array transporteert licht zonder vervorming
Waveguide-array transporteert licht zonder vervorming Mijnbouw van rotsen in een baan om de aarde kan helpen bij het verkennen van de diepe ruimte
Mijnbouw van rotsen in een baan om de aarde kan helpen bij het verkennen van de diepe ruimte Krachtige orkaan Hawaï gedegradeerd tot tropische storm
Krachtige orkaan Hawaï gedegradeerd tot tropische storm Scheve microcapsules geven lading vrij bij lagere osmotische druk die nodig is voor medicijnafgifte
Scheve microcapsules geven lading vrij bij lagere osmotische druk die nodig is voor medicijnafgifte de geometrie van accretieschijven voor nucleaire zwarte gaten
de geometrie van accretieschijven voor nucleaire zwarte gaten Wetenschappers vestigen record voor interactie tussen licht en materie
Wetenschappers vestigen record voor interactie tussen licht en materie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

