
Wetenschap
Een nieuwe klasse intramoleculaire bivalente lijm zou de ontdekking van geneesmiddelen tegen kanker kunnen transformeren
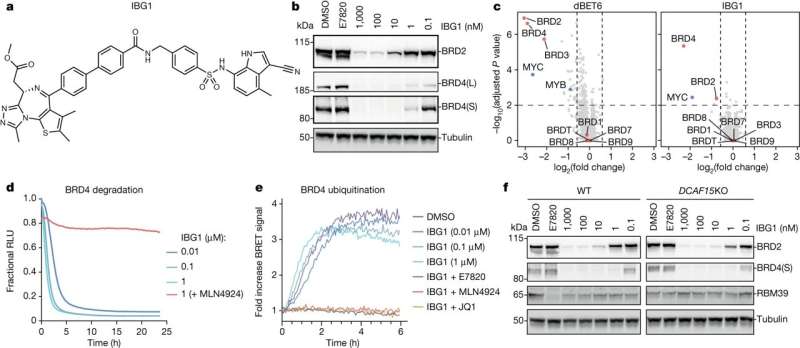
Een door de Universiteit van Dundee geïdentificeerde baanbrekende klasse van moleculaire lijm zou de weg kunnen vrijmaken voor een nieuwe generatie medicijnen die zich richten op kanker en neurodegeneratieve ziekten.
Een onderzoeksteam van het Centre for Targeted Protein Degradation (CeTPD) van de universiteit onder leiding van professor Alessio Ciulli, in samenwerking met de onderzoeksgroep van Dr. Georg Winter van het Research Center for Molecular Medicine (CEMM) van de Oostenrijkse Academie van Wetenschappen in Wenen, hebben een nieuwe klasse van zogenaamde 'intramoleculaire bivalente lijm' gedefinieerd, die eiwitten bindt (cruciaal voor de cellen die ervoor zorgen dat ons lichaam correct functioneert) die anders uit elkaar zouden blijven.
Dit onderzoek is gepubliceerd in het tijdschrift Nature .
"Deze bevindingen hebben grote gevolgen voor de hele farmaceutische industrie die zich bezighoudt met gerichte eiwitafbrekers", zegt professor Alessio Ciulli, directeur van Dundee's CeTPD.
"Dit geldt met name voor de ontwikkeling van medicijnen die zich richten op kanker, neurodegeneratieve ziekten en nog veel meer ziekten die worden veroorzaakt door eiwitten die altijd als onmediceerbaar zijn beschouwd."
"Eiwitten zijn essentieel voor het goed functioneren van onze cellen, maar als deze niet goed werken, is het lichaam kwetsbaar voor ziekten."
"De lijm die we hebben kunnen definiëren is speciaal omdat deze zich eerst op twee plaatsen aan één eiwit hecht (niet slechts één) en vervolgens het tweede eiwit recruteert, waardoor de twee eiwitten effectief aan elkaar worden gekoppeld."
"We hebben dit alleen kunnen identificeren met behulp van onze Targeted Protein Degradation-technologie en hebben een kwetsbaarheid geïdentificeerd die kan worden uitgebuit door het ontwerpen van nieuwe medicijnen die mogelijk de behandeling van kankerpatiënten en mensen met andere onbehandelbare ziekten kunnen transformeren."
Gerichte eiwitafbraak (TPD) is een opkomend gebied van de ontwikkeling van geneesmiddelen voor de behandeling van ziekten, waarbij eiwitrecyclingsystemen in onze cellen worden omgeleid om ziekteverwekkende eiwitten te vernietigen. De meeste TPD-strategieën maken gebruik van kleine moleculen (zogenaamde degraders) om deze doeleiwitten te rekruteren voor een klasse enzymen die ubiquitine E3-ligasen worden genoemd.
De E3 tagt het doeleiwit met ubiquitinelabels, wat uiteindelijk leidt tot de vernietiging van het ziekteverwekkende eiwit via de cellulaire afvalbak:het proteasoom.
In samenwerking met medewerkers van CEMM, de Goethe Universiteit van Frankfurt, en Eisai Co. Ltd, het Japanse farmaceutische bedrijf, is het Dundee-team erin geslaagd een nieuw mechanisme van moleculaire lijming te onthullen, anders dan de eerder bekende. Dit nieuwe mechanisme bindt zich aan twee kanten van het doeleiwit in plaats van aan slechts één, waardoor een herschikking van het hele eiwit wordt veroorzaakt en de voorheen onbekende interactie met de E3-ligase wordt gestabiliseerd.
Bovendien kon het team voor het eerst het precieze mechanisme visualiseren waarmee hun verbindingen werken en de doeleiwitten samenbrengen tot een van deze E3-ligasen. Omdat de moleculen twee koppen hebben, die zich vastklampen aan twee verschillende regio's binnen hetzelfde doeleiwit, worden deze 'intramoleculaire bivalente lijmen' genoemd.
Dit toonaangevende werk heeft ook voorheen ondergewaardeerde kenmerken en eigenschappen van moleculaire lijmen belicht, waardoor de weg werd vrijgemaakt voor wetenschappers om een dieper inzicht in lijmen te ontwikkelen, waardoor nieuwe klassen sneller ontdekt zouden kunnen worden.
“De impact van wat we hier hebben onthuld, kan niet worden onderschat”, voegde professor Ciulli eraan toe. "Dit zal een rimpeleffect veroorzaken in de hele farmaceutische industrie en heeft het potentieel om de manier waarop we naar de ontwikkeling van geneesmiddelen kijken te transformeren. Ik moet ook hulde brengen aan onze medewerkers, wier inbreng cruciaal is geweest bij het bereiken van deze seismische doorbraak."
Meer informatie: Alessio Ciulli, Gerichte eiwitafbraak via intramoleculaire bivalente genen, Natuur (2024). DOI:10.1038/s41586-024-07089-6. www.nature.com/articles/s41586-024-07089-6
Aangeboden door Universiteit van Dundee
 Zachte ondersteuning kan onverwacht stabiel glas maken
Zachte ondersteuning kan onverwacht stabiel glas maken  Onderzoek toont aan dat afzonderlijke atomen efficiëntere katalysatoren kunnen maken
Onderzoek toont aan dat afzonderlijke atomen efficiëntere katalysatoren kunnen maken Elektronenbewegingen in vloeistof gemeten in superslow motion
Elektronenbewegingen in vloeistof gemeten in superslow motion Afbeelding:Plastic sparrenbos
Afbeelding:Plastic sparrenbos Microben uit vulkanische openingen in de zee onthullen hoe mensen zich aanpasten aan een veranderende atmosfeer
Microben uit vulkanische openingen in de zee onthullen hoe mensen zich aanpasten aan een veranderende atmosfeer
Hoofdlijnen
- Supercoiling duwt moleculaire handboeien langs chromatinevezels
- Chromosoomorganisatie komt voort uit 1-D-patronen
- Waar bestaat het cytoplasma uit?
- Is Rust Dust schadelijk?
- Wie kan profiteren van klimaatverandering? Ratelslangen, suggereert onderzoek
- Hoe chloroplasten van wachtcellen energie verkrijgen
- Onderzoekers tonen aan dat grotere plantengemeenschappen productiever zijn en gevoeliger voor klimaatopwarming
- Slagen, grote oceaanreservaten moeten zowel het zeeleven als de mensen ten goede komen
- Verplaatste haviken gedijen goed in Hispaniola
- Eerder onbekende kristallijne fase van halfwaterig calciumcarbonaat ontdekt

- Selectie van molecuulgewichtpolymeer door eendimensionale opsluiting
- Experiment verbetert voorspellingen van uraniumverspreiding

- Moderne vervalsers ontmaskeren

- Nieuwe sonde met superresolutie legt cellen in ongekend detail vast
 Algemene relativiteitstheorie gebruikt om de optimale instapsnelheid van vliegtuigen te vinden
Algemene relativiteitstheorie gebruikt om de optimale instapsnelheid van vliegtuigen te vinden Miljardair Richard Branson bereikt ruimte in zijn eigen schip
Miljardair Richard Branson bereikt ruimte in zijn eigen schip Nano-antennes voor gegevensoverdracht
Nano-antennes voor gegevensoverdracht Klimaat in een zoetwaterbioom
Klimaat in een zoetwaterbioom  NASA's Perseverance rover zal door deze ogen naar Mars kijken
NASA's Perseverance rover zal door deze ogen naar Mars kijken Australië geeft staatsacteur de schuld van het hacken van politieke partijen
Australië geeft staatsacteur de schuld van het hacken van politieke partijen Hubble zet een hemelse sidekick in de schijnwerpers
Hubble zet een hemelse sidekick in de schijnwerpers Seizoenspatronen in de Amazone uitgelegd
Seizoenspatronen in de Amazone uitgelegd
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

