
Wetenschap
Onderzoek toont aan dat afzonderlijke atomen efficiëntere katalysatoren kunnen maken
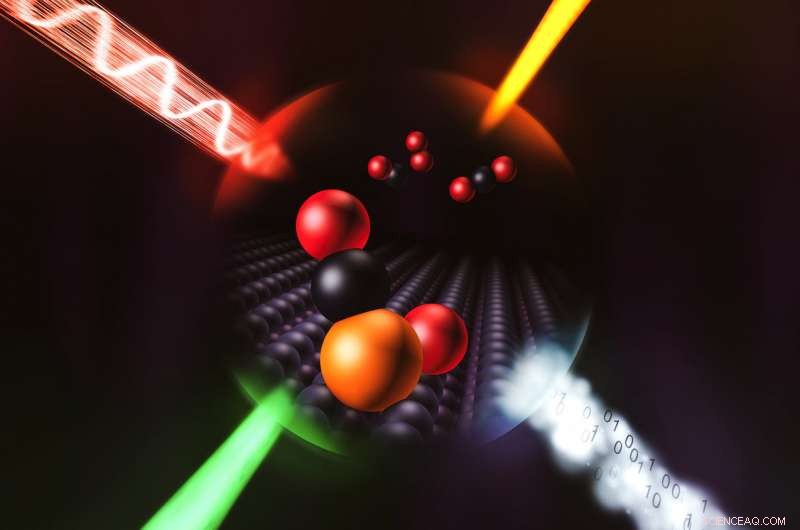
Wetenschappers gebruikten een combinatie van vier technieken, hier weergegeven door vier inkomende stralen, om in ongekend detail te onthullen hoe een enkel atoom van iridium een chemische reactie katalyseert. Krediet:Greg Stewart/SLAC National Accelerator Laboratory
Katalysatoren zijn chemische matchmakers:ze brengen andere chemicaliën dicht bij elkaar, de kans vergroten dat ze op elkaar reageren en iets produceren dat mensen willen, zoals brandstof of kunstmest.
Aangezien sommige van de beste katalysatormaterialen ook vrij duur zijn, zoals het platina in de katalysator van een auto, wetenschappers hebben gezocht naar manieren om de hoeveelheid die ze moeten gebruiken te verkleinen.
Nu hebben wetenschappers hun eerste directe, gedetailleerd bekijken hoe een enkel atoom een chemische reactie katalyseert. De reactie is dezelfde die giftige koolmonoxide uit auto-uitlaatgassen haalt, en individuele atomen van iridium deden het werk tot 25 keer efficiënter dan de iridium-nanodeeltjes met 50 tot 100 atomen die tegenwoordig worden gebruikt.
Het onderzoeksteam, geleid door Ayman M. Karim van Virginia Tech, rapporteerde de resultaten in Natuur Katalyse .
"Deze katalysatoren met één atoom zijn momenteel een hot topic, " zei Simon R. Bare, een co-auteur van de studie en een vooraanstaande stafwetenschapper bij het SLAC National Accelerator Laboratory van het Department of Energy, waar de belangrijkste onderdelen van het werk plaatsvonden. "Dit geeft ons een nieuwe lens om naar reacties te kijken, en nieuwe inzichten in hoe ze werken."
Karim heeft toegevoegd, "Voor zover we weten, dit is het eerste artikel dat de chemische omgeving identificeert die een enkel atoom katalytisch actief maakt, direct bepalen hoe actief het is in vergelijking met een nanodeeltje, en laten zien dat er zeer fundamentele verschillen zijn - totaal verschillende mechanismen - in de manier waarop ze reageren."
Is kleiner echt beter?
Katalysatoren vormen de ruggengraat van de chemische industrie en essentieel voor olieraffinage, waar ze helpen ruwe olie te breken in benzine en andere producten. De katalysatoren van tegenwoordig komen vaak voor in de vorm van nanodeeltjes die zijn bevestigd aan een oppervlak dat zo poreus is als een spons - zo vol met kleine gaatjes dat een enkele gram ervan, ontvouwd, een basketbalveld zou kunnen bedekken. Hierdoor ontstaat een enorm gebied waar miljoenen reacties tegelijk kunnen plaatsvinden. Wanneer gas of vloeistof over en door het sponsachtige oppervlak stroomt, chemicaliën hechten aan de nanodeeltjes, met elkaar reageren en wegdrijven. Elke katalysator is ontworpen om één specifieke reactie keer op keer te bevorderen.
Maar katalytische reacties vinden alleen plaats op de oppervlakken van nanodeeltjes, Bare zei, "en ook al zijn het hele kleine deeltjes, het dure metaal aan de binnenkant van het nanodeeltje gaat verloren."
individuele atomen, anderzijds, ultieme efficiëntie zou kunnen bieden. Elk atoom kan als katalysator werken, chemische reactanten grijpen en dicht bij elkaar houden totdat ze zich hechten. Je zou er veel meer in een bepaalde ruimte kunnen passen, en geen spatje edel metaal zou verloren gaan.
Enkele atomen hebben nog een ander voordeel:in tegenstelling tot clusters van atomen, die met elkaar verbonden zijn, enkele atomen zijn alleen aan het oppervlak bevestigd, dus hebben ze meer potentiële bindingsplaatsen beschikbaar om chemische trucjes uit te voeren – wat in dit geval erg handig was.
Onderzoek naar katalysatoren met één atoom is de afgelopen jaren explosief gestegen, Karim zei, maar tot nu toe heeft niemand in voldoende detail kunnen bestuderen hoe ze functioneren om alle vluchtige tussenstappen onderweg te zien.
Hulp zoeken
Voor meer informatie, het team keek naar een eenvoudige reactie waarbij enkele atomen van iridium zuurstofmoleculen in twee splitsten, en de zuurstofatomen reageren vervolgens met koolmonoxide om kooldioxide te creëren.
Ze gebruikten vier benaderingen:infraroodspectroscopie, elektronenmicroscopie, theoretische berekeningen en röntgenspectroscopie met bundels van SLAC's Stanford Synchrotron Radiation Lightsource (SSRL) - om het probleem vanuit verschillende hoeken aan te pakken, en dit was cruciaal om een compleet beeld te krijgen.
"Het is nooit één ding dat je het volledige antwoord geeft, "Zei Bare. "Het zijn altijd meerdere stukjes van de puzzel die in elkaar vallen."
Het team ontdekte dat elk iridium-atoom dat doet, in feite, voer een chemische truc uit die de prestaties verbetert. Het grijpt een enkel koolmonoxidemolecuul uit de passerende gasstroom en houdt het vast, als iemand die een pakje onder de arm stopt. De vorming van deze binding veroorzaakt kleine verschuivingen in de configuratie van de elektronen van het iridium-atoom die het helpen zuurstof te splitsen, zodat het veel efficiënter kan reageren met het resterende koolmonoxidegas en het veel efficiënter kan omzetten in kooldioxide.
Meer vragen liggen in het verschiet:zal hetzelfde mechanisme werken in andere katalytische reacties, waardoor ze efficiënter of bij lagere temperaturen kunnen werken? Hoe beïnvloeden de aard van de katalysator met één atoom en het oppervlak waarop het zich bevindt de binding met koolmonoxide en de manier waarop de reactie verloopt?
Het team is van plan om in januari terug te keren naar SSRL om het werk voort te zetten.
 Hoe elastiekjes krimpen
Hoe elastiekjes krimpen  Zeesponzen blijven zitten met ankers die buigen maar niet breken
Zeesponzen blijven zitten met ankers die buigen maar niet breken De toekomst van op halfgeleiders gebaseerde fotokatalytische processen opfleuren
De toekomst van op halfgeleiders gebaseerde fotokatalytische processen opfleuren Nieuw apparaat kan warmte-energie omzetten in een levensvatbare brandstofbron
Nieuw apparaat kan warmte-energie omzetten in een levensvatbare brandstofbron MIT-startup verpakt voedsel in zijde voor een betere houdbaarheid
MIT-startup verpakt voedsel in zijde voor een betere houdbaarheid
Hoofdlijnen
- De morfologie van algen
- Doden lindebomen bijen?
- Een DNA-model maken met piepschuimballen
- Hoe diepe hersenstimulatie werkt
- Het belang van DNA in de menselijke cel
- Wat levert elektronen voor de lichtreacties?
- Stropers richten zich op Afrikaanse leeuwen, gieren met vergif
- Licht schijnen op het sociale leven van virussen
- Wat is de ergste uitsterving in de geschiedenis van de aarde?
- Nieuw model voorspelt veranderingen in hout

- Nieuwe microfluïdische chip verhoogt de gevoeligheid van immunoassays met 1000x

- Katalysatoren gevonden om koolstofdioxide om te zetten in brandstof

- Zombie-scanning maakt de studie van peptide-receptor-interacties op het celoppervlak mogelijk
- Chemici ontwikkelen een veelbelovende methode voor medicijnsynthese
 Zou jij je auto dumpen als het openbaar vervoer gratis zou zijn? Dit is wat onderzoekers hebben gevonden
Zou jij je auto dumpen als het openbaar vervoer gratis zou zijn? Dit is wat onderzoekers hebben gevonden Infraroodfotodetectoren met hoog rendement die gouden nanostaafjes gebruiken
Infraroodfotodetectoren met hoog rendement die gouden nanostaafjes gebruiken De verborgen kosten van misdaad:Tanzanianen betalen maar liefst 7 procent om geld te beschermen tegen diefstal
De verborgen kosten van misdaad:Tanzanianen betalen maar liefst 7 procent om geld te beschermen tegen diefstal Drie graden temperatuurstijging zal Europese inspanningen voor emissiereductie tenietdoen
Drie graden temperatuurstijging zal Europese inspanningen voor emissiereductie tenietdoen Over Chipmunks
Over Chipmunks  Belang van steekproefgrootte in onderzoek
Belang van steekproefgrootte in onderzoek  Yellowstone veroorzaakte twee superuitbarstingen die het wereldwijde klimaat veranderden
Yellowstone veroorzaakte twee superuitbarstingen die het wereldwijde klimaat veranderden Naarmate VIP online wachtlijsten aan populariteit winnen, studie vindt mogelijke valkuilen
Naarmate VIP online wachtlijsten aan populariteit winnen, studie vindt mogelijke valkuilen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com

