
Wetenschap
Ontwikkeld multivalent zelf-geassembleerd bindereiwit tegen SARS-CoV-2 RBD
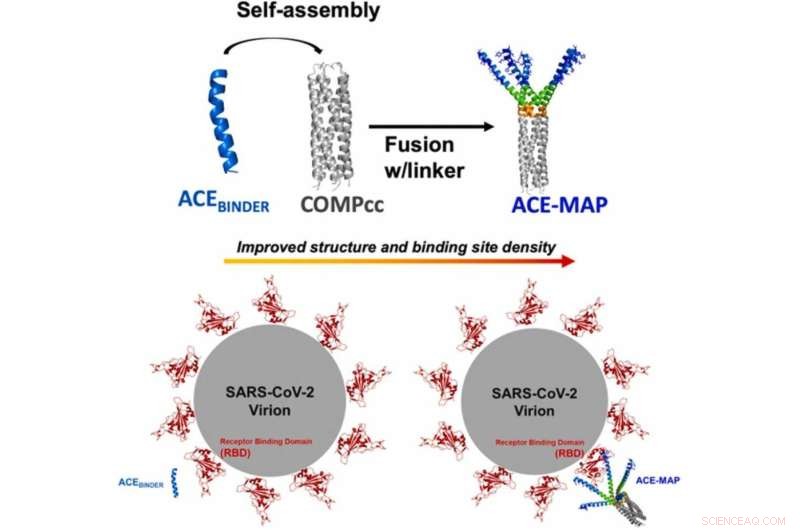
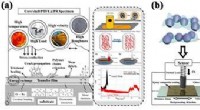
Grafisch abstract. Credit:Biochemical Engineering Journal (2022). DOI:10.1016/j.bej.2022.108596
Sinds het in 2019 verscheen, heeft COVID-19 meer dan 6 miljoen levens geëist en de samenleving over de hele wereld op zijn kop gezet. De aandoening, veroorzaakt door het SARS-CoV-2-virus, tast onder meer cellen in de longen, het hart en de hersenen aan. Onderzoekers realiseerden zich al snel dat de ziekte deze organen zo dramatisch aantastte omdat de kenmerkende pieken zich aan het angiotensine-converterende enzym 2 of ACE2-receptor bonden. Het eiwit - dat veel voorkomt in die organen - biedt het toegangspunt voor het coronavirus om cellen in te haken en te infecteren.
ACE2-receptoren waren dus de voor de hand liggende keuze bij het testen op of behandelen van COVID-19. Door de ACE2 te recreëren en in een geïnfecteerd lichaam te introduceren, zou het virus zich aan het eiwit binden, zichzelf onthullend in een test of zich bezighouden met een "nep"-receptor. Maar vertrouwen op het ACE2-eiwit alleen biedt mogelijk niet voldoende binding om het virus te vinden en te bestrijden.
Nu hebben onderzoekers uit heel NYU en onder leiding van Jin Kim Montclare, hoogleraar chemische en biomoleculaire engineering aan NYU Tandon, een nieuw eiwit gecreëerd dat een verhoogd vermogen heeft om zich aan virussen te binden, waardoor een efficiënter hulpmiddel ontstaat in de strijd tegen COVID-19 . Het geheim is het creëren van een versie van ACE2 die een multivalent geassembleerd eiwit (MAP) nabootst. Multivalente geassembleerde eiwitten zijn als natuurlijk voorkomende antilichamen. Hun lichamen hebben meerdere sites die kunnen linken en binden aan de virussen die ze proberen aan te vallen, waardoor ze veel effectiever zijn in het aanhaken van hun doelen.
De ACE-MAP die het team heeft ontworpen, maakt gebruik van een spiraalvormig oligomeer matrixeiwit van kraakbeen, een nanomateriaal dat het laboratorium van Montclare eerder in verschillende toepassingen heeft gebruikt. Toen ze werden gefuseerd met een deel van ACE2 over het oppervlak van de spoel, ontdekten ze dat de nieuwe materialen de valentie aanzienlijk verhoogden in vergelijking met ACE2 alleen, en mogelijk aan meerdere viruslichamen tegelijk binden in plaats van aan één.
Dit nieuwe materiaal heeft potentiële toepassingen bij zowel detectie als behandeling. Omdat het biomateriaal zoveel effectiever is in het hechten aan virale lichamen, zou het minder nodig hebben in vergelijking met de natuurlijke antilichamen die momenteel in tests en therapieën worden gebruikt. Deze technologie heeft mogelijke toepassingen bij het testen en behandelen van andere ziekten met bekende receptoren en een vergelijkbare structuur, zoals HIV. Lopend onderzoek zal de effectiviteit van ACE-MAP in andere modellen bevestigen en kan in de toekomst een belangrijk onderdeel zijn van de strijd tegen COVID-19. + Verder verkennen
Antilichaam dat een breed scala aan gevonden sarbecovirussen remt
 Meerderheid grondwatervoorraden bestand tegen klimaatverandering
Meerderheid grondwatervoorraden bestand tegen klimaatverandering Hoe post-truth politiek het debat over de hervorming van de milieubeoordeling doet zinken
Hoe post-truth politiek het debat over de hervorming van de milieubeoordeling doet zinken Suomi NPP Satellite kijkt Helene in de ogen
Suomi NPP Satellite kijkt Helene in de ogen Burgemeester van New York richt zich op klassieke wolkenkrabbers met Green New Deal
Burgemeester van New York richt zich op klassieke wolkenkrabbers met Green New Deal Onderzoekers kraken de Karakoram-anomalie
Onderzoekers kraken de Karakoram-anomalie
Hoofdlijnen
- Studie kijkt naar de invloed van woonwerven op voedselwebben
- Oedogonium Life Cycle
- Voorheen onbekende dinosaurussoort geïdentificeerd in het zuidwesten van Duitsland
- Zijn gelukkige mensen gezonder?
- Waarom zout zouthoudend water ontmoedigen?
- Bottom-up-proces speelt een centrale rol bij het bepalen van interactienetwerken tussen mieren
- Seizoensgebonden afbeeldingen onthullen de wetenschap achter stamcellen
- Hoe beïnvloedt stress je hersens?
- Wat zijn de niveaus van organisatie in de biologie?
- Moleculen bouwen zoals Tinkertoys? Een doorbraakstudie kan de weg effenen
- Brandstofcellen voor waterstofvoertuigen gaan langer mee

- Onderzoekers ontwikkelen krachtige strategie voor het maken van nieuwe natuurlijke enzymen

- Batterijonderzoek:nieuwe doorbraken in onderzoek naar superbatterijen
- Ontwikkeling van kern-schaal functionele composieten met uitstekende zelfsmerende eigenschappen
 Giftige algenbloei wordt erger, maar overzicht ontbreekt
Giftige algenbloei wordt erger, maar overzicht ontbreekt Kunstmatige intelligentie kan worden gebruikt om geheimen te onthullen achter traditionele volksmuziek die duizenden jaren oud is
Kunstmatige intelligentie kan worden gebruikt om geheimen te onthullen achter traditionele volksmuziek die duizenden jaren oud is Wat is een semi-aride klimaat?
Wat is een semi-aride klimaat?  Een speld in een hooiberg vinden:ontdekking van Ti2InB2 voor het synthetiseren van gelaagde TiB
Een speld in een hooiberg vinden:ontdekking van Ti2InB2 voor het synthetiseren van gelaagde TiB COVID-19-antilichaamtesten:hoe betrouwbaar zijn ze?
COVID-19-antilichaamtesten:hoe betrouwbaar zijn ze? Vietnams nieuwste luchtvaartmaatschappij Bamboo krijgt luchtvaartvergunning
Vietnams nieuwste luchtvaartmaatschappij Bamboo krijgt luchtvaartvergunning De samensmelting van een zwart gat met een neutronenster en het daaropvolgende proces in één enkele simulatie modelleren
De samensmelting van een zwart gat met een neutronenster en het daaropvolgende proces in één enkele simulatie modelleren Renault en Fiat Chrysler vast over fusievoorwaarden:rapport
Renault en Fiat Chrysler vast over fusievoorwaarden:rapport
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

