
Wetenschap
Hoe een kwalvormige structuur de druk in je cellen verlicht
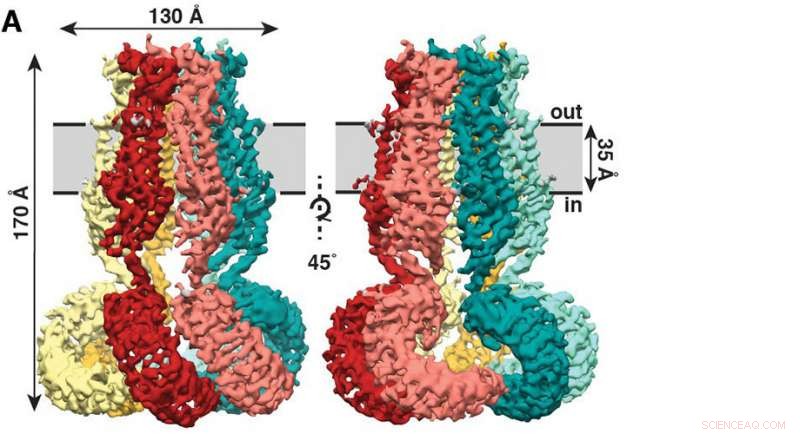
De nieuwe studie, onlangs gepubliceerd in het tijdschrift eLife , laat zien dat SWELL1 is gemaakt van zes subeenheden die elkaar bovenaan ontmoeten, samengebundeld om een kwalachtige mantel te vormen met zes ranken die naar beneden hangen. Krediet:Kefauver et al, Scripps-onderzoek
Wetenschappers van Scripps Research hebben de structuur opgelost van een belangrijk eiwit dat voelt wanneer onze cellen opzwellen. Dit eiwit, genaamd SWELL1 (of LRRC8A), werkt als een "ionkanaal" op het celmembraan om de druk in de cellen te verlichten.
De nieuwe studie, onlangs gepubliceerd in het tijdschrift eLife , laat zien dat SWELL1 is gemaakt van zes subeenheden die elkaar bovenaan ontmoeten, samengebundeld om een kwalachtige mantel te vormen met zes ranken die naar beneden hangen.
"Deze structuur geeft een eerste glimp van hoe dit ionenkanaal veranderingen in volume in een cel waarneemt, " zegt Jennifer Kefauver, afgestudeerde student bij Scripps Research, het Howard Hughes Medisch Instituut, en eerste auteur van de nieuwe studie.
SWELL1 werd in 2014 ontdekt in het lab van Ardem Patapoutian, doctoraat, professor bij Scripps Research en onderzoeker bij het Howard Hughes Medical Institute. De ontdekking opende de deur naar cruciale studies naar de werking van het eiwit.
De volgende belangrijke stap was om licht te werpen op de moleculaire structuur van SWELL1. De wetenschappers wilden de basis begrijpen van hoe dit ionenkanaal veranderingen in volume waarneemt. Om dit te doen, ze moesten de moleculaire machinerie van het kanaal bekijken.
Kefauver leidde studies als een gezamenlijke student tussen de laboratoria van Patapoutian en Andrew Ward, doctoraat, professor bij Scripps Research en leider in een beeldvormingstechniek met hoge resolutie genaamd cryo-elektronenmicroscopie (cryo-EM). Kefauver gebruikte cryo-EM-technieken om de kwalachtige structuur van SWELL1 op te lossen en een eerste blik te werpen op hoe ionen door de centrale porie van het kanaal kunnen reizen. "Jennifer heeft de structuur van SWELL1 met grote vasthoudendheid nagestreefd, geen middel onbeproefd laten en ontelbare hindernissen overwinnen. Het was geweldig om te zien hoe de vruchten van haar arbeid resulteren in zo'n mooie structuur, " zei Ward.
Deze nieuwe kijk op het ionkanaal suggereert dat interagerende delen van de ranken-sites die een positieve of een negatieve lading hebben, een verandering in ionsterkte in de cel (een verdunning van het zoutgehalte van de cel als het water absorbeert) voelen. De geladen resten kunnen een signaal naar de porie van het kanaal sturen, het kanaal vertellen om chloride-ionen uit de cel vrij te maken en de druk te verlichten.
Kefauver hoopt dat deze nieuwe kijk op de structuur medisch onderzoek kan voeden. SWELL1 speelt een rol bij ten minste één ziekte:een immuundeficiëntie die agammaglobulinemie wordt genoemd. "Het hebben van de structuur is erg belangrijk voor wetenschappers die proberen te begrijpen hoe dit kanaal werkt en wat ziekteverwekkende mutaties kunnen doen."
Volgende, de onderzoekers hebben nader bekeken hoe de verschillende delen van de SWELL1-structuur de kanaalfunctie beïnvloeden. Ze ontdekten dat het muteren van het eiwit op een van de twee plaatsen de structuur ervan weerhoudt om het verkeer door het ionenkanaal goed te regelen.
De nieuwe studie toont bundels van de SWELL1-subeenheid alleen - en wetenschappers weten dat SWELL1 er moet zijn voor een functioneel kanaal. Maar maximaal vier andere subeenheden kunnen op verschillende locaties in de structuur wisselen. Kefauver zegt dat de volgende stap is om te bepalen hoe verschillende combinaties van SWELL1-subeenheden samenkomen om ionenkanalen met verschillende activiteiten te vormen.
 Drie hoofddelen van een seed
Drie hoofddelen van een seed Wetenschappers heroverwegen co-evolutie van het leven in zee, zuurstofrijke oceanen
Wetenschappers heroverwegen co-evolutie van het leven in zee, zuurstofrijke oceanen Delen van Spanje en Portugal zijn meer dan 46 C – dit is wat er aan de hand is
Delen van Spanje en Portugal zijn meer dan 46 C – dit is wat er aan de hand is Video:Hoe kunnen we eten zonder de planeet te koken?
Video:Hoe kunnen we eten zonder de planeet te koken? Zomer Euraziatische niet-uniforme opwarming gevonden in verband met de Atlantische multidecadale oscillatie
Zomer Euraziatische niet-uniforme opwarming gevonden in verband met de Atlantische multidecadale oscillatie
Hoofdlijnen
- Artefacten suggereren aankomst van mensen in Australië 18,
- Waarom DNA de meest gunstige molecule is voor genetisch materiaal en hoe RNA zich hiermee verhoudt
- Wat zijn dromen?
- De circadiane klok bepaalt het tempo van de plantengroei
- In het wild als ecologisch uitgestorven beschouwd, Birmese sterschildpadpopulatie is gegroeid tot meer dan 14, 000 personen
- Waarom bevatten niet alle plantencellen chloroplasten?
- Woestijnsprinkhanen - nieuwe risico's in het licht van klimaatverandering
- Hoe celstructuren te identificeren
- Onderzoek naar de levensstijl van microben
- Belang van Hydrogen

- 3D bioprinten van levende structuren met ingebouwde chemische sensoren

- Veelzijdige nieuwe materiaalfamilie kan realistische protheses bouwen, futuristische legerplatforms

- Materiaal voor veiligere voetbalhelmen kan hoofdletsel verminderen

- Onderzoekers klokken DNA's hersteltijd na chemotherapie

 Wetenschappers vinden het oudst bekende gefossiliseerde spijsverteringskanaal van 550 miljoen jaar oud
Wetenschappers vinden het oudst bekende gefossiliseerde spijsverteringskanaal van 550 miljoen jaar oud Lieve schat, Ik heb de vacuümkamers gekrompen!
Lieve schat, Ik heb de vacuümkamers gekrompen! Nieuwsbericht:Onderzoekers gebruiken magnetisme om medicijnen op ziekteplaatsen te houden
Nieuwsbericht:Onderzoekers gebruiken magnetisme om medicijnen op ziekteplaatsen te houden Afbeelding:De nacht in kaart brengen
Afbeelding:De nacht in kaart brengen Energizer Watt-uur batterijspecificaties
Energizer Watt-uur batterijspecificaties  Afbeeldingen tekenen op een grafische rekenmachine
Afbeeldingen tekenen op een grafische rekenmachine  Computerprogramma kan een 2D-tekening in vrije vorm vertalen naar een DNA-structuur
Computerprogramma kan een 2D-tekening in vrije vorm vertalen naar een DNA-structuur Wat is het eerste kwartiel?
Wat is het eerste kwartiel?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Swedish | Norway |

-
Wetenschap © https://nl.scienceaq.com

