
Wetenschap
Nieuwe strategie om subtypes van sleuteleiwit precies te targeten
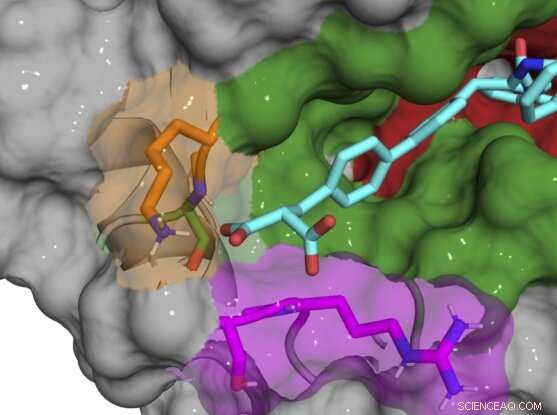
X-ray co-kristalstructuur van B52-verbinding (cyaan) die cyclofiline D-eiwit bindt en remt. Krediet:Aziz Rangwala
Cyclosporine is een van de meest voorkomende en effectieve immunosuppressiva die worden gebruikt voor de behandeling van chronische ziekten zoals artritis en psoriasis, maar het brengt een risico op ernstige bijwerkingen met zich mee. Wetenschappers denken dat dit kan zijn omdat het medicijn zich in het algemeen richt op cyclofilinen, een familie van 17 regulerende eiwitten die verschillende rollen spelen bij het bevorderen van cellulaire gezondheid. Hoewel elk afzonderlijk cyclofiline-subtype een unieke rol speelt, richten veel huidige immunosuppressiva zich op het hele gezin, wat betekent dat belangrijke onbekende routes per ongeluk kunnen worden uitgeschakeld of anderszins kunnen worden gewijzigd.
Het probleem wordt gecompliceerd door het feit dat de actieve plaats waar moleculen binden bijna identiek is voor alle 17 cyclofilinen, wat het moeilijk maakt voor medicijnmakers om zich op specifieke subtypes te richten. In een artikel dat vandaag is gepubliceerd in Nature Chemical Biology , wetenschappers in het laboratorium van Broad Institute Core Member David Liu, die ook de directeur is van het Merkin Institute of Transformative Technologies in Healthcare bij Broad, in samenwerking met de laboratoria van Markus Seeliger bij SUNY Stony Brook en Institute Member Vamsi Mootha in Massachusetts General Het ziekenhuis heeft een nieuwe oplossing voorgesteld.
In plaats van zich te richten op de actieve plaats van cyclofiline-eiwitten, beschrijven onderzoekers in Liu's laboratorium een proces dat verbindingen vindt die binden aan de "exo-site", een klein zakje naast de actieve site dat in grootte en vorm varieert over verschillende cyclofilinen. Met behulp van geïsoleerde eiwitten in een reageerbuis ontdekte het team verschillende verbindingen die uitsluitend Cyclophilin D (CypD) binden en remmen, een eiwit dat betrokken is bij het openen en sluiten van mitochondriale poriën. Ze pasten ook soortgelijke principes toe om unieke, selectieve remmers voor Cyclophilin E (CypE) te ontdekken. De auteurs zeggen dat hun studie de basis legt voor wetenschappers om aanvullende subtype-selectieve cyclofilineremmers te ontwikkelen, waarvan sommige nuttig kunnen zijn als hulpmiddelen voor biologie of als aanknopingspunten voor therapeutische ontwikkeling.
"Het is een nieuwe bindingsmodus die profiteert van een zak die mensen nog niet volledig hebben verkend", zegt hoofdauteur Alex Peterson, nu een postdoctoraal fellow bij het Scripps Research Institute, die het project leidde als een afgestudeerde student in Liu's lab, zei . "Het is een soort blauwdruk voor hoe mensen in de toekomst selectieve cyclofilineremmers kunnen ontwerpen."
Gebruikmaken van nieuwe en oude technologieën
CypD reguleert de mitochondriale permeabiliteitstransitieporie (mPTP), kleine poriën op het binnenoppervlak van mitochondriën (beroemd bekend als de krachtpatser van de cel). Wanneer CypD oxidatieve stress of hoge calciumniveaus detecteert, haast het zich om de mPTP te openen, waardoor water en andere ionen in en uit de mitochondriën kunnen stromen.
Deze opening van de mitochondriale sluizen kan een probleem worden met ziekten zoals ischemie-reperfusieschade, diabetes, neurodegeneratieve aandoeningen, leverziekten en meer. Aangezien deze aandoeningen abnormaal hoge niveaus van oxidatieve stress kunnen veroorzaken, houdt CypD de mitochondriale poriën langer open dan normaal, wat leidt tot mitochondriale disfunctie, scheuren en celdood. Men denkt dat medicijnen die de reactie van CypD op hoge oxidatieve stress vertragen en remmen, kunnen worden gebruikt om tal van ziekten te behandelen.
Om verbindingen op te sporen die uitsluitend aan CypD binden, wendde het team zich tot DNA-gecodeerde bibliotheken met kleine moleculen, een technologie die meer dan twintig jaar geleden werd ontwikkeld als een van de eerste projecten in Liu's toen nieuwe laboratorium. Onderzoekers kunnen de bibliotheken, die gevuld zijn met honderdduizenden synthetische verbindingen die zijn bevestigd aan unieke DNA-barcodes, gebruiken om te scannen op moleculen die binden aan gewenste eiwitten. Door geïsoleerde CypD-eiwitten en een verzameling van 256.000 unieke DNA-gecodeerde verbindingen in een reageerbuis te mengen, identificeerde het team honderden veelbelovende verbindingen.
De meeste van de aanvankelijke verbindingen bonden nog steeds in en rond de actieve plaats, waardoor meerdere cyclofiline-subtypen werden geremd, dus het team bracht geleidelijk kleine chemische veranderingen aan in hun verbindingen om ze uniek te maken voor CypD. Toen ze eenmaal ontdekten dat de exo-site de sleutel was tot het ontwikkelen van subtype-specifieke remmers, waren ze in staat een paar verbindingen te ontwerpen die CypD krachtig remmen en andere cyclofilinen minimaal aantasten. X-ray co-kristalstructuren van het CypD-eiwit en de remmers tijdens de ontwikkeling gaven het team een kijkje achter de schermen van de precieze locatie waar hun moleculen aan het binden waren.
De onderzoekers behandelden vervolgens geïsoleerde mitochondriën met hun twee belangrijkste verbindingen en merkten op dat ze effectief waren in het vertragen van CypD's opening van mitochondriale poriën. De spiegelbeelden van hun verbindingen, die CypD niet remmen, vertoonden geen activiteit in mitochondriën. Om te bewijzen dat hun succes geen geïsoleerd incident was, herhaalden ze de strategie opnieuw voor CypE, een cyclofiline die verantwoordelijk is voor het reguleren van mRNA-verwerking. Opnieuw ontwikkelden ze een verbinding die zich er exclusief op richtte en lieten de resterende 16 cyclofilinen ongefaseerd achter.
Het team hoopt dat hun bevindingen uiteindelijk chemische biologen en medicijnfabrikanten kunnen helpen bij het bouwen van betere en specifiekere cyclofiline-gerichte medicijnen. Ze gaven zelfs toekomstige wetenschappers een voorsprong - omdat de CypD-gerichte verbindingen moeite hebben om zelf menselijke cellen binnen te komen, heeft het team ze aangepast door esterderivaten toe te voegen die effectief het plasmamembraan omzeilen en in de mitochondriën terechtkomen.
"Het werk van ons team heeft ons uiteindelijk in staat gesteld dit al lang bestaande probleem te overwinnen:hoe rem je selectief slechts één cyclofiline-subtype op 17?" zei Liu, die ook een onderzoeker van het Howard Hughes Medical Institute is. "In de toekomst zullen moleculen die voortkomen uit het gebruik van onze strategie, naar ik hoop nuttig blijken te zijn, zowel voor de basiswetenschap als mogelijk voor therapieën." + Verder verkennen
Nieuwe synthesestrategie versnelt identificatie van eenvoudigere versies van een natuurlijk product
 Wetenschappers ontwikkelen een materiaal voor gebruik in stralingstolerante apparaten
Wetenschappers ontwikkelen een materiaal voor gebruik in stralingstolerante apparaten Nieuw apparaat produceert waterstofperoxide voor waterzuivering
Nieuw apparaat produceert waterstofperoxide voor waterzuivering Bewerkt plantaardig toxine bezit anti-tumor eigenschappen
Bewerkt plantaardig toxine bezit anti-tumor eigenschappen Geavanceerd kankermedicijn krimpt en intercaleert DNA
Geavanceerd kankermedicijn krimpt en intercaleert DNA Hoe bacteriën een enzym bouwen dat klimaatveranderend lachgas vernietigt
Hoe bacteriën een enzym bouwen dat klimaatveranderend lachgas vernietigt
 Leverde de hitte van de inslagen op asteroïden de ingrediënten voor het leven op aarde?
Leverde de hitte van de inslagen op asteroïden de ingrediënten voor het leven op aarde? Nieuwe toolset evalueert economische effecten van ozonreductiebeleid voor negen inkomensgroepen
Nieuwe toolset evalueert economische effecten van ozonreductiebeleid voor negen inkomensgroepen Groeiende wereldbevolking:onderzoek naar voedselproductie mist een holistisch perspectief
Groeiende wereldbevolking:onderzoek naar voedselproductie mist een holistisch perspectief Wat zijn groenten en fruit die onder de grond groeien?
Wat zijn groenten en fruit die onder de grond groeien?  Bijna twee miljoen hectare in brand in de Verenigde Staten
Bijna twee miljoen hectare in brand in de Verenigde Staten
Hoofdlijnen
- Wat is een wetland? Een ecoloog legt uit
- Wetenschappers werken aan een omkeerbare vorm van genbewerking
- Geurende reinigingsproducten: The New Smoking?
- Geen bewijs dat het onthoornen van zwarte neushoorns een negatieve invloed heeft op de voortplanting of overleving van de soort, studievondsten
- Studie suggereert nieuwe doelen voor het verbeteren van het sojaoliegehalte
- Kunnen genetisch gemodificeerde muggen malaria uitroeien?
- Is het tijd dat ons begrip van evolutie evolueert?
- Beperkingen Enzymen die worden gebruikt in DNA-vingerafdrukken
- Science Fair Ideas With the Topic Dance
- Kristallisatie opgehelderd, onderzoekers rapporteren

- Zo ontdek je snel nieuwe materialen

- Wetenschappers ontwikkelen eerste medicijnachtige verbindingen om ongrijpbare, aan kanker gerelateerde enzymen te remmen

- Zout smelt geen ijs - zo maakt het de winterse straten echt veilig

- Wetenschappers ontdekken mogelijke methode om de bacteriën die tuberculose veroorzaken uit te hongeren
 LOFAR-radiotelescoop onthult geheimen van zonnestormen
LOFAR-radiotelescoop onthult geheimen van zonnestormen IJzer in het vuur:onderzoekers stellen vast hoe ijzerafzettingen ontstaan
IJzer in het vuur:onderzoekers stellen vast hoe ijzerafzettingen ontstaan Nieuwe katalysatoren voor betere brandstofcellen
Nieuwe katalysatoren voor betere brandstofcellen Hoe microgrammen naar micromollen converteren
Hoe microgrammen naar micromollen converteren Plaats delict tape gaat een revolutie teweegbrengen in het onderzoek naar microplastics
Plaats delict tape gaat een revolutie teweegbrengen in het onderzoek naar microplastics Hoe het volume van een hole te berekenen
Hoe het volume van een hole te berekenen Onderzoekers onthullen een nieuw metaal waar elektronen stromen met vloeistofachtige dynamiek
Onderzoekers onthullen een nieuw metaal waar elektronen stromen met vloeistofachtige dynamiek Nieuwe materialen van perovskiet dagen traditionele noties van hogedrukchemie uit
Nieuwe materialen van perovskiet dagen traditionele noties van hogedrukchemie uit
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

