
Wetenschap
Wetenschappers ontdekken mogelijke methode om de bacteriën die tuberculose veroorzaken uit te hongeren
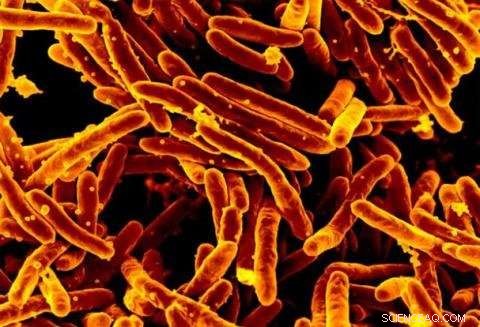
Scanning-elektronenmicrofoto van Mycobacterium tuberculosis-bacteriën, die tbc veroorzaken. Krediet:NIAID
De infectieziekte Tuberculose (TB) is wereldwijd een van de belangrijkste doodsoorzaken. Hoewel het aantal tbc in Canada sinds de jaren tachtig relatief stabiel is gebleven, de ziekte treft onevenredig veel inheemse bevolkingsgroepen. Nu tbc-veroorzakende bacteriën steeds resistent worden tegen antibiotica, onderzoekers en medicijnmakers staan te popelen om nieuwe, effectievere behandelingen.
Onderzoekers weten al een tijdje dat de bacterie die tbc (Mycobacterium tuberculosis) veroorzaakt, het cholesterol van ons lichaam - een steroïde - als voedselbron gebruikt. Andere verwanten van de bacteriën die geen ziekte veroorzaken, delen het vermogen om steroïden af te breken. In dit onderzoek, het team van de Universiteit van Guelph identificeerde de structuur van een enzym (acyl-CoA-dehydrogenase) dat betrokken is bij de afbraak van steroïden in een ander lid van dezelfde bacteriefamilie, genaamd Thermomonospora curvata.
Dr. Stephen Seah, een lid van het onderzoeksteam, het bepalen van de structuur van enzymen die steroïden metaboliseren, brengt wetenschappers en farmaceutische bedrijven een stap dichter bij het maken van medicijnen die een soortgelijk enzym kunnen remmen dat wordt aangetroffen in M. tuberculosis, die TB effectief van zijn voedselbron zou verhongeren. De bevindingen zijn onlangs gepubliceerd in het tijdschrift Biochemie .
Door te weten hoe een enzym eruitziet - zijn structuur - kunnen wetenschappers de vorm van een medicijn aanpassen aan het enzymdoelwit. Zonder de structuur als roadmap, wetenschappers onderzoeken vaak veel doodlopende wegen voordat ze bij een medicijn komen dat goed past bij het enzymdoelwit. Met behulp van de CMCF-bundellijn op de CLS, het team was in staat om een foto te maken van het "sleutelgat" waarin medicijnmoleculen moeten passen.
Dr. Matthew Kimber, een ander lid van het team van de Universiteit van Guelph, zei dat hun bevindingen helpen begrijpen hoe dit enzym kan worden gericht. "We waren verrast om te zien dat deze enzymen buitengewoon bedreven zijn in het veranderen van hun vorm terwijl ze hun verschillende taken uitvoeren, " zei Kimber. "Dit werk helpt ons de exacte vorm van het sleutelgat te begrijpen dat een medicijn zou moeten vullen om dit enzym te stoppen."
Hun ontdekking, zei Zee, zou niet mogelijk zijn geweest zonder toegang tot de CLS-bundellijn. "We zijn sterk afhankelijk van de CLS voor de röntgenbron om de structuur van onze enzymen te bepalen, " zei Seah. "Er is een sterke relatie tussen hoe helder de röntgenstralen zijn en hoeveel details je kunt zien in de uiteindelijke beelden."
De bevindingen van het team kunnen medicijnmakers ook helpen nieuwe steroïde-gerelateerde medicijnen te maken, zoals ontstekingsremmende of kankerbestrijdende medicijnen. "Dit zou moeten helpen bij het bouwen van een gereedschapskist voor het maken van nieuwe steroïde medicijnen, of het efficiënter maken van degenen die we wel gebruiken, ' zei Kimber.
 Welke oceaan is de kleinste ter wereld?
Welke oceaan is de kleinste ter wereld?  Hoe het tijdperk van een boom te vertellen
Hoe het tijdperk van een boom te vertellen Simulaties suggereren dat arme tropische regio's waarschijnlijk meer te lijden zullen hebben van de opwarming van de aarde
Simulaties suggereren dat arme tropische regio's waarschijnlijk meer te lijden zullen hebben van de opwarming van de aarde Zeekaarten uit de 18e eeuw onthullen koraalverlies
Zeekaarten uit de 18e eeuw onthullen koraalverlies Dodental bij ongekende overstromingen Iran loopt op tot 21
Dodental bij ongekende overstromingen Iran loopt op tot 21
Hoofdlijnen
- Wetenschappers ontwikkelen aardnoot die resistent is tegen aflatoxine
- De jacht op een van de Top 50 meest gezochte schimmels is voorbij
- Wat zijn de vijf onderverdelingen van koninkrijken?
- Drie manieren waarop genetische diversiteit optreedt tijdens meiose
- Wat zijn enkele voor- en nadelen van het gebruik van DNA-analyse om wetshandhaving bij misdrijven te ondersteunen?
- Je kunt echt op je naam lijken,
- Wat zijn de purine basen van DNA?
- Kun je verslaafd zijn aan endorfine?
- Parasitaire planten vertrouwen op een ongebruikelijke methode om hun zaden te verspreiden
- Wat is de rol van pigmenten in fotosynthese?

- Afvalwater van olijfmolens getransformeerd:van verontreinigende stof tot bio-meststof, biobrandstof
- Verbetering van de hechting van kunststoffen in uiterst nauwkeurige microfluïdische chips

- Materiaalwetenschappers maken sterker kobalt voor brandstofcellen

- Een nieuwe methode voor kwantitatieve schatting van de mate van overeenkomst van coördinatieveelvlakken

 Onderzoek toont aan dat er tijdens perioden van stress minder mannen in de VS zijn geboren
Onderzoek toont aan dat er tijdens perioden van stress minder mannen in de VS zijn geboren BP zegt winst eerste kwartaal met 70% te stijgen
BP zegt winst eerste kwartaal met 70% te stijgen Vormveranderende boten en waar ze te vinden zijn
Vormveranderende boten en waar ze te vinden zijn  Slimme handpompen voorspellen diepten van grondwater in Afrika
Slimme handpompen voorspellen diepten van grondwater in Afrika Windsnelheid lezen met behulp van een Ribbon
Windsnelheid lezen met behulp van een Ribbon Algoritme met adelaarsogen overtreft menselijke experts
Algoritme met adelaarsogen overtreft menselijke experts Nieuwe methode voor nanomaterialen geeft antwoord op lastige uitdagingen
Nieuwe methode voor nanomaterialen geeft antwoord op lastige uitdagingen Massagraf Zwarte Dood ontdekt in 14e-eeuws kloosterziekenhuis
Massagraf Zwarte Dood ontdekt in 14e-eeuws kloosterziekenhuis
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Danish | Norway | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

