
Wetenschap
Zout smelt geen ijs - zo maakt het de winterse straten echt veilig

Het strooien van zout op wegen is een veiligheidsmaatregel. Krediet:stoatphoto/Shutterstock.com
Brrr … het is koud daarbuiten! Kinderen stromen massaal naar de televisie in de hoop te horen dat er een sneeuwdag komt; de gangen voor brood en melk bij supermarkten zijn leeg vanwege een dreigende sneeuwstorm; en nutsvrachtwagens sproeien zout of zout water op de wegen.
We weten allemaal waarom de eerste twee gebeuren - kinderen zijn opgewonden voor een vrije dag vol met warme chocolademelk en sneeuwpoppen. Volwassenen slaan de benodigdheden in. Maar hoe zit het met die vrachtwagens?
Ze werken om bestuurders te beschermen tegen gladde omstandigheden door steenzout of een oplossing van zout water te sproeien om ijsvorming te voorkomen. Dit zout lijkt erg op het zout dat je op tafel hebt staan – het is hetzelfde natriumchloride, NaCl. Er zijn enkele gepatenteerde mengsels die andere zouten bevatten, zoals kaliumchloride (KCl) en magnesiumchloride (MgCl), maar ze worden niet zo vaak gebruikt.
Wegenzout is niet zo puur als wat je op je eten gebruikt; het heeft een bruingrijze kleur, voornamelijk door minerale vervuiling. Het milieu blootstellen aan dit zout via afvoer kan enkele onbedoelde gevolgen hebben, waaronder negatieve effecten op planten, waterdieren en moerassen.
Maar het is een goedkope en effectieve manier om wegen te beschermen tegen ijs dankzij een eenvoudig wetenschappelijk principe:vriespuntverlaging van oplossingen. Het vriespunt van zuiver water, de temperatuur waarbij het ijs wordt, is 32 graden Fahrenheit. Dus als er sneeuw ligt, ijzel of ijsregen en de grond is 32 F of kouder, vast ijs zal vormen op straten en trottoirs.
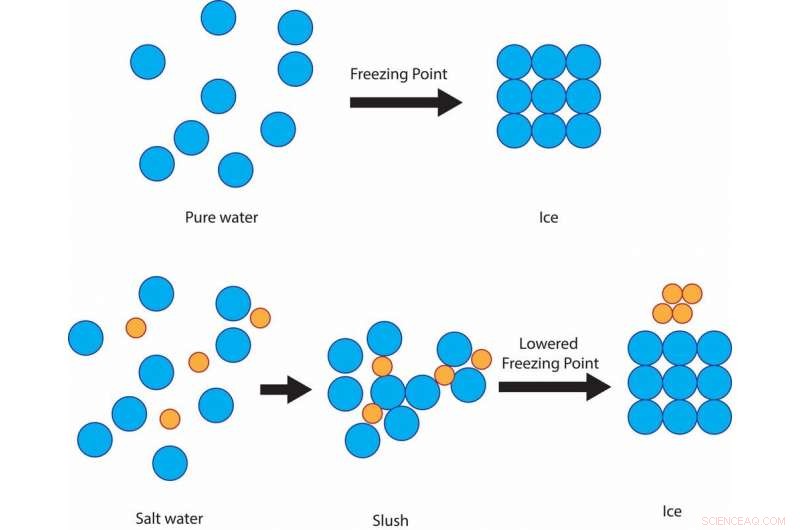
Zout voorkomt dat de watermoleculen stollen tot ijskristallen bij 32 F, in plaats daarvan modderig blijven bij die temperatuur, voordat het uiteindelijk rond 15 F bevriest. Credit:Julie Pollock, CC BY-ND
Als het water wordt gemengd met zout, Hoewel, de vriestemperatuur van de oplossing is lager dan 32 F. Het zout belemmert het vermogen van de watermoleculen om vaste ijskristallen te vormen. De mate van vriespuntverlaging hangt af van hoe zout de oplossing is.
Het is belangrijk op te merken dat het zout in een oplossing met vloeibaar water moet zijn om aan dit principe te voldoen. Dat is de reden waarom veel steden een zoutoplossing sproeien voordat er ijs wordt gevormd.
Zout dat op ijs wordt gedumpt, is afhankelijk van de zon of de wrijving van autobanden die eroverheen rijden om het ijs in eerste instantie te smelten tot een smeltende sneeuwbrij die zich met het zout kan vermengen en vervolgens niet opnieuw bevriest. Voorbehandeling met vast zout is afhankelijk van het warmere wegdek om in eerste instantie eventuele sneeuw of ijzel te laten smelten, zodat het zich goed met het zout kan vermengen. Dit is ook de reden waarom voorbehandeling van bruggen – die kouder zijn dan andere wegen – doorgaans niet werkt, en waarom je de borden "brug bevriest voor weg" ziet.
Deze zoutoplossingen verlagen de vriestemperatuur van water tot ongeveer 15 F. Dus, helaas voor mensen die met echt ijskoude temperaturen te maken hebben, behandelen met zout zal het ijs op hun wegen niet wegnemen.
Een alternatieve strategie die bij deze lagere temperaturen wordt gebruikt, is zand op het ijs leggen. Zand verandert de smelttemperatuur niet, het biedt gewoon een ruw oppervlak voor uw banden om uitglijden en glijden te voorkomen.
De wetenschap van vriespuntdepressie kan op elke oplossing worden toegepast, en veel onderzoeksgroepen hebben zich gericht op het ontwikkelen van alternatieven met minder negatieve gevolgen voor het milieu. Ze bevatten additieven zoals melasse en bietensap. Dus misschien kun je je verheugen op het schoonmaken van niet alleen wit zout van de onderkant van je jeans na een winterwandeling, maar ook roze zout.
Dit artikel is opnieuw gepubliceerd vanuit The Conversation onder een Creative Commons-licentie. Lees het originele artikel. 
 De omvang van het poolijs aan het einde van de zomer is de achtste laagste ooit geregistreerd
De omvang van het poolijs aan het einde van de zomer is de achtste laagste ooit geregistreerd Honderden wetenschappers beginnen aan een missie om de voorspellingen van de luchtkwaliteit te verbeteren
Honderden wetenschappers beginnen aan een missie om de voorspellingen van de luchtkwaliteit te verbeteren Tropische depressie 15E lijkt bijna vormloos op NASA-satellietbeelden
Tropische depressie 15E lijkt bijna vormloos op NASA-satellietbeelden NASA ziet Ockhi sterker worden voor de zuidwestkust van India
NASA ziet Ockhi sterker worden voor de zuidwestkust van India Gezond om te eten, ongezond om te groeien - Aardbeien belichamen de tegenstellingen van de Californische landbouw
Gezond om te eten, ongezond om te groeien - Aardbeien belichamen de tegenstellingen van de Californische landbouw
Hoofdlijnen
- Waarom heeft een regenworm een gesloten bloedsomloop?
- Wetenschappers onderzoeken hoe olie de kleinste organismen in Antarctische wateren beïnvloedt
- Welke gebeurtenis volgt DNA-replicatie in een celcyclus?
- Het belang van asymmetrie bij bacteriën
- Wat zijn de 4 kenmerken die biologen gebruiken om levende dingen te herkennen?
- Klimaatverandering, bevolkingsgroei kan leiden tot aquacultuur in open oceaan
- De wilde ezel keert terug
- Zeeslakken weten hoe ze hun huisvestingskosten moeten begroten
- G2-fase: wat gebeurt er in deze subfase van de celcyclus?
- Ontworpen moleculen verwijderen selectief ongewenste ionen uit complexe oplossingen voor energieproductie

- Onthulling van de onverwachte structuur van ijzer-exporteur ferroportine
- Onderzoekers ontwikkelen een koolstofveer met hoge samendrukbaarheid en rekbaarheid

- Video:Hoe kook je een ei zonder hitte - en andere rare eierwetenschap

- Magnetische T-Budbots gemaakt van theeplanten doden en reinigen biofilms

 Startup bevordert koolstofvrije brandstoffen via UConn-partnerschap
Startup bevordert koolstofvrije brandstoffen via UConn-partnerschap Wetenschappers werken aan het maken van microchip-elementen van moleculaire grootte
Wetenschappers werken aan het maken van microchip-elementen van moleculaire grootte De puzzel oplossen van polymeren die aan ijs binden voor cryopreservatie
De puzzel oplossen van polymeren die aan ijs binden voor cryopreservatie Veelzijdige C. difficile-blokker
Veelzijdige C. difficile-blokker Types of Environmental Ecosystems
Types of Environmental Ecosystems Wat is het verschil tussen een ion en een elektrolyt?
Wat is het verschil tussen een ion en een elektrolyt?  Nieuwe methode kan scheuren in metaal opsporen lang voordat ze catastrofes veroorzaken
Nieuwe methode kan scheuren in metaal opsporen lang voordat ze catastrofes veroorzaken Welk effect heeft de temperatuur op het diffusieproces?
Welk effect heeft de temperatuur op het diffusieproces?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

