
Wetenschap
Inzicht in enzymevolutie baant de weg voor groene chemie
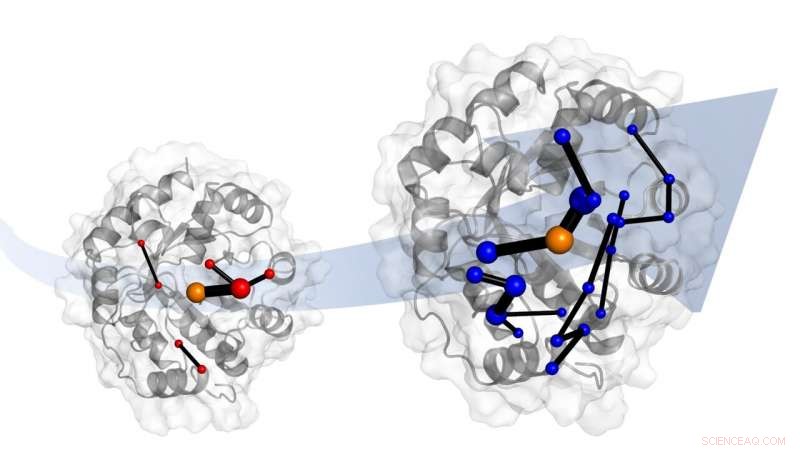
De laboratoriumevolutie van een designer-enzym maakt het tot een veel betere katalysator. Simulaties tonen aan dat evolutie dit doet door netwerken van aminozuren te introduceren. Deze netwerken beloven sjablonen te zijn voor katalysatorontwerp. Krediet:Dr. Adrian Bunzel
Onderzoekers van de Universiteit van Bristol hebben aangetoond hoe laboratoriumevolutie aanleiding kan geven tot zeer efficiënte enzymen voor nieuwe-naar-natuurreacties, de deur openen voor nieuwe en milieuvriendelijkere manieren om drugs en andere chemicaliën te maken.
Wetenschappers hebben eerder vanaf het begin eiwitkatalysatoren ontworpen met behulp van computers, maar deze zijn veel minder capabel dan natuurlijke enzymen. Om hun prestaties te verbeteren, een techniek genaamd laboratoriumevolutie kan worden gebruikt, waarmee de Amerikaanse scheikundig ingenieur Frances Arnold pionierde en waarvoor ze in 2018 de Nobelprijs ontving. Geregisseerde evolutie imiteert natuurlijke selectie, waardoor wetenschappers de kracht van biologie kunnen gebruiken om het vermogen van eiwitten te verbeteren om taken uit te voeren, zoals het katalyseren van een specifieke chemische reactie.
Maar hoewel het onderzoeksteam onlangs laboratoriumevolutie had gebruikt om een ontworpen enzym met meer dan 1 te verbeteren, 000 vouwen, het was onbekend hoe de evolutie haar activiteit verhoogt. Tot nu.
Hoofdauteur Professor Adrian Mulholland van Bristol's School of Chemistry zei:"Evolutie kan katalysatoren veel actiever maken. Het punt is, evolutie werkt op mysterieuze manieren:bijvoorbeeld, mutaties die de katalyse blijkbaar verbeteren, omvatten vaak veranderingen in aminozuren ver van de actieve plaats waar de reactie plaatsvindt."
"We wilden begrijpen hoe evolutie inefficiënte designer-biokatalysatoren kan transformeren in zeer actieve enzymen.", de eerste auteur van de studie, Dr. Adrian Bunzel, zei.
Om dit te doen, het internationale onderzoeksteam uit Bristol, de ETH Zürich en de Universiteit van Waikato (NZ) wendden zich tot moleculaire computersimulaties. "Deze laten zien dat evolutie de manier waarop het eiwit beweegt verandert - de dynamiek ervan. Simpel gezegd, evolutie 'stemt' de flexibiliteit van het hele eiwit af, " hij voegde toe.
Het team identificeerde ook het netwerk van aminozuren in het eiwit dat verantwoordelijk is voor deze 'afstemming'. Bij deze netwerken zijn delen van het eiwit betrokken die door evolutie zijn veranderd.
Dr. Bunzel zei:"Na evolutie, het hele eiwit lijkt samen te werken om de reactie te versnellen. Dit is belangrijk omdat wanneer we enzymen ontwerpen, we richten ons vaak alleen op de actieve site, en vergeet de rest van het eiwit."
Prof Mulholland voegde toe:"Dit soort analyse zou kunnen helpen om effectievere 'de novo'-enzymen te ontwerpen, voor reacties waar we voorheen niet op konden mikken."
Het onderzoek, gepubliceerd in Natuurchemie , onthult hoe evolutie designer-enzymen krachtiger maakt, de weg vrijmaken voor op maat gemaakte katalysatoren voor groene chemie.
De onderzoekers zullen hun bevindingen nu gebruiken om nieuwe eiwitkatalysatoren te ontwerpen.
 Onderzoeksteam publiceert baanbrekende ontdekking van methaansynthese
Onderzoeksteam publiceert baanbrekende ontdekking van methaansynthese Onderzoekers onderzoeken de effecten van klimaatverandering op honger
Onderzoekers onderzoeken de effecten van klimaatverandering op honger Frances door orkaan getroffen St. Maarten op wacht voor gezondheidsbedreigingen
Frances door orkaan getroffen St. Maarten op wacht voor gezondheidsbedreigingen De effecten van zwerfvuil op het milieu en dieren
De effecten van zwerfvuil op het milieu en dieren Waarom het verhogen van de productie van schaliegas de uitstoot van broeikasgassen niet zal verminderen?
Waarom het verhogen van de productie van schaliegas de uitstoot van broeikasgassen niet zal verminderen?
Hoofdlijnen
- Wat betekent Kaukasisch echt?
- Wat zijn organellen in een prokaryotische cel?
- Celwand: definitie, structuur en functie (met diagram)
- Lawaai van industriële ontwikkeling zal dieren benadrukken en de ecologie in nationale monumenten veranderen
- Behoud oproep aan zaagviskwekerij
- Hoe empathie werkt
- Habitat telt wanneer roofdieren op de loer liggen
- Hoe cranberrymoerassen werken
- Welke drie dingen helpen bloed door aderen te duwen?
- Hoe materialen te programmeren

- 's Werelds eerste productie van aluminium scandiumnitride via MOCVD

- Hebben de warmte en zon invloed op zwembadchloor?

- Wetenschappers bieden perspectieven op cavitatiewetenschap

- Een superatoom synthetiseren:deuren openen voor hun gebruik als vervanging voor elementaire atomen

 Veldgeologie op Mars-evenaar wijst op oude megaflood
Veldgeologie op Mars-evenaar wijst op oude megaflood De zon gaat onder op onhoudbare lange afstanden, toerisme voor kort verblijf, van regionale reisbubbels de toekomst maken
De zon gaat onder op onhoudbare lange afstanden, toerisme voor kort verblijf, van regionale reisbubbels de toekomst maken Eiland Mayotte in de Indische Oceaan op cycloonalarm
Eiland Mayotte in de Indische Oceaan op cycloonalarm Inzicht in kwikdamplampen en -balans
Inzicht in kwikdamplampen en -balans Hoe Delta X in te voeren op een Ti-84
Hoe Delta X in te voeren op een Ti-84  Kleinere klassen betekent meer succes voor vrouwen in STEM
Kleinere klassen betekent meer succes voor vrouwen in STEM Haaienbioloog werkt samen met ruimtevaartingenieur om het gedrag van oceanische wittips te ontdekken
Haaienbioloog werkt samen met ruimtevaartingenieur om het gedrag van oceanische wittips te ontdekken Onderzoekers schatten de grootte van een vogel met ongebruikelijke vocale biomechanica aan de hand van zijn zang
Onderzoekers schatten de grootte van een vogel met ongebruikelijke vocale biomechanica aan de hand van zijn zang
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

