
Wetenschap
Wetenschappers ontwikkelen betere manier om virussen te blokkeren die luchtweginfecties bij kinderen veroorzaken
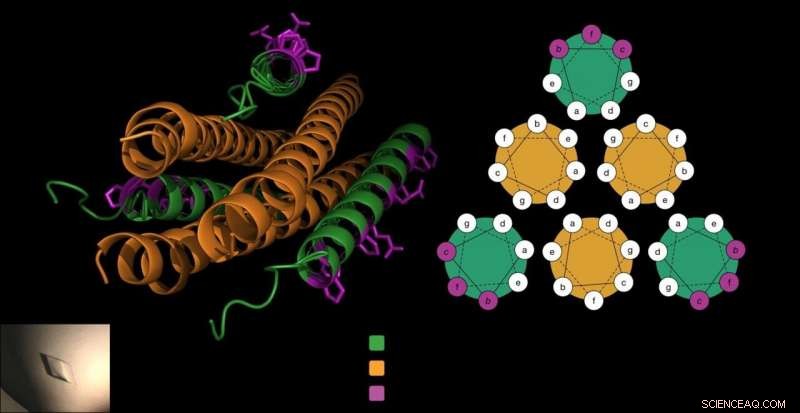
Het antivirale peptide bestaat uit drie kurkentrekkers (in groen), die het fusie-eiwit van het virus (in oranje) omsluiten om te voorkomen dat het virus de cellen binnendringt. Het Gellman-lab voegde unieke bèta-aminozuren toe aan het peptide (in paars) op een manier die deze cruciale interactie niet verstoorde en het peptide stabieler maakte. Krediet:Victor Outlaw.
Door een klein stukje eiwit te manipuleren, of peptide, die de aanhechting van menselijke para-influenzavirussen aan cellen kunnen voorkomen, onderzoekers hebben een methode verbeterd in knaagdiermodellen die bedoeld zijn om kinderen gezond te houden.
Menselijke para-influenzavirussen, of HPIV's, zijn de belangrijkste oorzaak van luchtweginfecties bij kinderen, verantwoordelijk voor 30% tot 40% van ziekten zoals kroep en longontsteking. De virussen treffen ook ouderen en mensen met een gecompromitteerd immuunsysteem.
Om mensen ziek te maken, HPIV's moeten zich vastklampen aan cellen en hun genetisch materiaal injecteren om nieuwe virussen te maken. HPIV3 komt het meest voor onder deze virussen. Er zijn momenteel geen goedgekeurde vaccins of antivirale middelen voor HPIV3-infectie bij mensen.
In een onderzoek onder leiding van het Sam Gellman-lab op de afdeling scheikunde van de Universiteit van Wisconsin-Madison, en het laboratorium van Anne Moscona en Matteo Porotto aan de Columbia University, onderzoekers bouwden voort op jarenlang werk aan peptidebehandelingen om er een te genereren die het HPIV3-aanhechtingsproces kan blokkeren.
De onderzoekers publiceerden hun bevindingen op 7 april in de Tijdschrift van de American Chemical Society .
Om gastheercellen binnen te gaan, HPIV's gebruiken gespecialiseerde fusie-eiwitten die lijken op drie naast elkaar gelegde kurkentrekkers. Eerder werk van het Moscona-Porotto-lab toonde aan dat wetenschappers een gedeeltelijk deel van dit kurkentrekker-eiwit van HPIV3, introduceren dit peptide aan het virus, en voorkomen dat de kurkentrekker het infectieproces aanstuurt. het peptide, zelf een kurkentrekker, sluit in wezen dicht met de kurkentrekkers van het virus, het creëren van een strakke bundel van zes kurkentrekkervormen.
Het nieuwe peptide blijft langer in het lichaam aanwezig, waardoor het ongeveer drie keer effectiever is in het blokkeren van infectie in knaagdiermodellen van ziekte dan de oorspronkelijke vorm.
Het onderzoeksteam begon door te proberen het originele peptide te manipuleren om beter bestand te zijn tegen eiwitverterende enzymen in het lichaam, die eiwitten gemakkelijk kunnen versnipperen en onbruikbaar maken. Dus, het Gellman-lab wendde zich tot ongebruikelijke bouwstenen om een sterker peptide te creëren.
Cellen bouwen eiwitten op uit alfa-aminozuren. Maar chemici kunnen bèta-aminozuren maken, die vergelijkbaar zijn, maar een extra koolstofatoom hebben. Wanneer peptiden deze bèta-aminozuurbouwstenen gebruiken, ze nemen vaak een andere vorm aan vanwege het extra atoom. Dit kan een peptide helpen zich te verbergen voor eiwitverterende enzymen en langer te overleven.
Echter, de onderzoekers wisten ook dat als de vorm van het peptide te veel veranderde als gevolg van deze ongebruikelijke bouwstenen, ze sluiten mogelijk niet samen met HPIV's kurkentrekkerfusie-eiwit.
Dat is waar de decennialange ervaring van het Gellman-lab met het testen en wijzigen van bèta-aminozuurbevattende peptiden van cruciaal belang werd.
"We weten welke kant van het peptide zich bindt aan zijn eiwitdoelwit. Dus, we (wisten dat we) alleen residuen kunnen modificeren die niet direct betrokken zijn bij het binden van het virale eiwit, " zegt Victor Outlaw, een postdoctoraal onderzoeker in het lab en een van de co-eerste auteurs van het rapport. Bij laboratoriumtesten, ze zagen dat het zorgvuldig gemodificeerde peptide nog steeds sterk aan het eiwit van het virus bond.
In een andere verbetering die is ontwikkeld door het Moscona-Porotto-lab, de wetenschappers haakten het peptide aan op een molecuul cholesterol. Deze vettoevoeging helpt het peptide in het vettige celmembraan te glijden, waar het het virus het beste kan blokkeren.
"Onze hypothese was dat de combinatie van bèta-aminozuren en cholesterol de antivirale werkzaamheid zou verhogen, " zegt Outlaw, die uitlegde dat de cholesterol hielp om het peptide te krijgen waar het heen moest, terwijl de vormverandering van de bèta-aminozuren ervoor zorgde dat het peptide langer in het lichaam bleef.
Zoals het onderzoeksteam hoopte, toen ze het nieuwe peptide aan katoenratten gaven, bleef het veel langer in de longen dan de vorige versie, dankzij de weerstand tegen vertering door enzymen. Het peptide werd in de neuzen van de ratten afgeleverd.
Om te testen hoe goed het peptide werkte om infectie te voorkomen, katoenratten kregen het nieuwe peptide voordat ze werden blootgesteld aan HPIV3. In vergelijking met dieren die geen antivirale peptiden kregen, degenen die het verbeterde peptide kregen, hadden 10 keer minder virussen in hun longen.
En vergeleken met het peptide dat gevoeliger was voor enzymen, het sterkere peptide verminderde de virale belasting met ongeveer drie keer, wat suggereert dat het vermogen van het nieuwe peptide om de spijsvertering in het lichaam te voorkomen, helpt om infecties beter te blokkeren.
Hoewel de aanpak nog niet op mensen is getest en onderzoekers het systeem verder moeten verfijnen en testen, het biedt wel een nieuwe strategie om deze veelvoorkomende infecties mogelijk te voorkomen of te behandelen.
De onderzoekssamenwerking is nu op zoek naar peptiden van de tweede generatie die nog langer in het lichaam blijven. Ze willen ook testen hoe goed het gemodificeerde peptide infectie door verwante virussen kan blokkeren. Dat aanvullend onderzoek zou de peptidebehandeling dichter bij klinische proeven kunnen brengen.
"Dit was een zeer gelukkige samenkomst van groepen die complementaire behoeften en capaciteiten hadden, ", zegt Gellman. "Het is echt een geweldige gezamenlijke inspanning geweest."
 Wetenschappers halen waterstofgas uit olie en bitumen, potentiële vervuilingsvrije energie geven
Wetenschappers halen waterstofgas uit olie en bitumen, potentiële vervuilingsvrije energie geven Precipitatie Titratie Technieken
Precipitatie Titratie Technieken Hoe onderscheidt titratie zich van colorimetrie?
Hoe onderscheidt titratie zich van colorimetrie?  Wat is de vergelijking voor het vinden van de begintemperatuur?
Wat is de vergelijking voor het vinden van de begintemperatuur?  X-ray fluorescentie mapping om tumorpenetratie te meten door een nieuw middel tegen kanker
X-ray fluorescentie mapping om tumorpenetratie te meten door een nieuw middel tegen kanker
 Statistisch model laat zien dat aardbevingen in Groningen deels naschokken zijn
Statistisch model laat zien dat aardbevingen in Groningen deels naschokken zijn Waarom slagen we er nog steeds niet in om de ontbossing te stoppen?
Waarom slagen we er nog steeds niet in om de ontbossing te stoppen? Studie vindt dat vervuiling dodelijker is dan oorlog, ramp, honger
Studie vindt dat vervuiling dodelijker is dan oorlog, ramp, honger Ondanks minder ozonvervuiling, niet alle planten profiteren
Ondanks minder ozonvervuiling, niet alle planten profiteren Toegewijde CO2-uitstoot brengt internationale klimaatdoelen in gevaar, studie vondsten
Toegewijde CO2-uitstoot brengt internationale klimaatdoelen in gevaar, studie vondsten
Hoofdlijnen
- Ziekteresistente appels presteren beter dan oude favorieten
- Er is een gemakkelijke manier om mitose en meiose te begrijpen
- Wetenschappers werken aan een omkeerbare vorm van genbewerking
- Hoe kunnen kinderen van dezelfde ouders er zo verschillend uitzien?
- De soorten weefsels waarvan DNA kan worden geëxtraheerd om DNA-vingerafdrukken te maken
- Hoe erg is zwarte schimmel,
- Heeft de menselijke intelligentie duizenden jaren geleden een hoogtepunt bereikt?
- Stadsuitbreiding in Perth die het seksleven van planten beïnvloedt
- The Stages of the Human Decomposition Process
- Kleurveranderende verbanden detecteren en behandelen bacteriële infecties

- Aangeraakt door licht:Foto-geëxciteerde stannylanionen zijn geweldig voor het produceren van organotinverbindingen

- Studie beschrijft cellulaire fabrieken in meer detail
- Nieuwe studie helpt bij het karakteriseren van de fusie van metalen

- Wetenschappers ontwikkelen zeer gevoelige moleculaire optische druksensor

 Chinezen dringen aan op boycot Amerikaanse bedrijven maar Big Mac-fans niet overtuigd
Chinezen dringen aan op boycot Amerikaanse bedrijven maar Big Mac-fans niet overtuigd De economische gevolgen van COVID-19 met één schip tegelijk volgen
De economische gevolgen van COVID-19 met één schip tegelijk volgen Techniek geeft gedetailleerd inzicht in hoe bepaalde polymeren worden gevormd, antwoorden ontsluiten over kiemvorming
Techniek geeft gedetailleerd inzicht in hoe bepaalde polymeren worden gevormd, antwoorden ontsluiten over kiemvorming Wetenschappers hebben de eiwit- en lipidensamenstelling van het Siberische mammoetbot ontdekt
Wetenschappers hebben de eiwit- en lipidensamenstelling van het Siberische mammoetbot ontdekt Fiat Chrysler en vakbond bereiken voorlopige contractovereenkomst in de VS
Fiat Chrysler en vakbond bereiken voorlopige contractovereenkomst in de VS Grafeen vermenigvuldigt de kracht van licht
Grafeen vermenigvuldigt de kracht van licht Een atoom in een holte haalt zeer zuivere enkelvoudige fotonen uit zwak laserlicht
Een atoom in een holte haalt zeer zuivere enkelvoudige fotonen uit zwak laserlicht Water op Mars niet zo wijdverbreid als eerder werd gedacht, studie vondsten
Water op Mars niet zo wijdverbreid als eerder werd gedacht, studie vondsten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Danish | Norway | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

