Wetenschap
Studie kan het ontwerp van peptiden helpen stimuleren
Krediet:CC0 Publiek Domein
peptiden, die korte reeksen aminozuren zijn, een vitale rol spelen in de gezondheidszorg en de industrie met een enorm scala aan medische toepassingen, waaronder antibiotica, anti-inflammatoire en anti-kanker medicijnen. Ze worden ook gebruikt in de cosmetica-industrie en voor het verbeteren van atletische prestaties. Het veranderen van de structuur van natuurlijke peptiden om verbeterde verbindingen te produceren is daarom van groot belang voor wetenschappers en de industrie. Maar hoe de machines die deze peptiden produceren werken, is nog steeds niet helemaal duidelijk.
Universitair hoofddocent Max Cryle van het Biomedicine Discovery Institute (BDI) van de Monash University heeft een belangrijk aspect van peptidemachines onthuld in een paper gepubliceerd in Natuurcommunicatie vandaag die een sleutel biedt tot de heilige graal van het opnieuw ontwerpen van peptiden.
De bevindingen zullen het werk van zijn laboratorium bevorderen om glycopeptide-antibiotica opnieuw te ontwikkelen om de dringende wereldwijde dreiging van antimicrobiële resistentie tegen te gaan. en meer in het algemeen om de eigenschappen van peptiden in het algemeen te verbeteren.
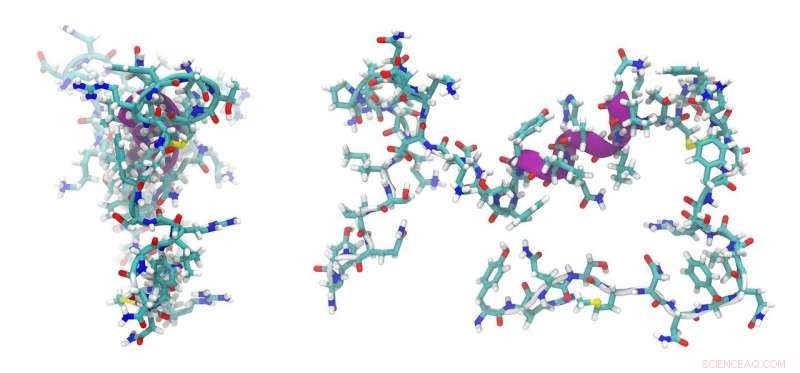
"Peptidesynthesemachines zijn vaak grotendeels modulaire assemblagelijnen, waarbij elke module uit verschillende onderdelen bestaat. Veranderen wat je maakt in deze assemblagelijnen, dat is, peptiden met nieuwe biologische activiteiten, is een 'heilige graal' in herontwerp, Universitair hoofddocent Cryle zei. "Een van de dingen die we in deze studie probeerden te begrijpen, was waar de selectiviteit van deze machines vandaan komt - ze zijn erg selectief voor het maken van één specifiek peptide en begrijpen waar deze specificiteit vandaan komt, is een beetje een mysterie, " hij zei.
"We waren in staat om een deel van zo'n machinerie dat de koppelingen binnen de peptiden genereert structureel te karakteriseren in een stadium dat niet eerder is bepaald. Wat we hebben laten zien is dat deze domeinen die verantwoordelijk zijn voor het koppelen van aminozuren aan peptiden niet spelen een algemene rol bij het selecteren van de aminozuren tijdens dit proces."
"Dit is goed nieuws vanuit het oogpunt van re-engineering, omdat het betekent dat we ons geen zorgen hoeven te maken over het veranderen van meerdere onderdelen van de machine om enkele aminozuurveranderingen aan te brengen, we moeten ons gewoon concentreren op het veranderen van de bouwsteen die erin gaat en dat is veelbelovend."
Universitair hoofddocent Cryle leidde een multidisciplinair team van wetenschappers die een verscheidenheid aan technieken gebruikten om de peptidestructuren te modelleren, waaronder het gebruik van de Australian Synchrotron voor röntgenkristallografie, samen met chemische en biochemische technieken. Hij werkte samen met groepen in Canberra, Brisbane en Duitsland die hielpen met computationele modellering en bio-informatica.
"Ons vermogen om de enzymen te begrijpen die natuurlijke peptiden maken, is de sleutel tot ons vermogen om verbeterde te produceren om problemen aan te pakken zoals antimicrobiële resistentie, " zei hij. "Nu kunnen we echt gaan nadenken over manieren om de acceptatie van verschillende bouwstenen door de machine te veranderen en op deze manier kunnen we nieuwe peptiden maken met verbeterde antibacteriële eigenschappen, " hij zei.
In de toekomst, een samenwerking met de groep van Dr. Evi Stegmann aan de Universiteit van Tübingen in Duitsland zal helpen de bevindingen te vertalen van een theoretische laboratoriumoplossing naar het uiteindelijk ontwikkelen van een productie op commerciële schaal van nieuwe en verbeterde antibiotica, hij zei.
 Drie overeenkomsten tussen een verbinding en een Element
Drie overeenkomsten tussen een verbinding en een Element Scherpste beeld van Alzheimer-fibrillen toont voorheen onbekende details
Scherpste beeld van Alzheimer-fibrillen toont voorheen onbekende details Wat zijn de effecten van een alkalische pH op de structuur van DNA?
Wat zijn de effecten van een alkalische pH op de structuur van DNA?  Nieuw biologisch afgeleid metaal-organisch raamwerk bootst DNA na
Nieuw biologisch afgeleid metaal-organisch raamwerk bootst DNA na Onderzoeken naar enkelvoudige deeltjes wijzen de weg naar lichtschermen van de volgende generatie
Onderzoeken naar enkelvoudige deeltjes wijzen de weg naar lichtschermen van de volgende generatie
Hoofdlijnen
- Onderzoekers vinden eiwit dat antibioticaresistentie kan helpen bestrijden
- Wat zijn de stadia van de celcyclus?
- Drie mechanismen van genetische recombinatie in Prokaryotes
- Ongedierteresistentie tegen biotech-gewassen stijgt
- Wat zijn twee kenmerken van mRNA in eukaryoten?
- Hoe afnemende zoogdierpopulaties in de Florida Everglades verband houden met de invasieve Birmese python
- Nieuwe aanpak kan de sleutel zijn tot de behandeling van antibioticaresistente bacteriën
- Dode walvis verrast zwemmers op iconisch strand van Rio
- Your Brain On: An All Nighter
 Tropische cycloon Irving lijkt langwerpig op NASA-beelden
Tropische cycloon Irving lijkt langwerpig op NASA-beelden Bepalen van de hoeveelheid en locatie van lipiden in de hersenen
Bepalen van de hoeveelheid en locatie van lipiden in de hersenen Verwachte toename van neerslag is slecht nieuws voor de waterkwaliteit
Verwachte toename van neerslag is slecht nieuws voor de waterkwaliteit Onderlinge afhankelijkheid tussen planten en dieren
Onderlinge afhankelijkheid tussen planten en dieren Branden schaden de inspanningen van Californië om klimaatverandering te beteugelen
Branden schaden de inspanningen van Californië om klimaatverandering te beteugelen Grafeen en kobalt voor het maken van nieuwe elektromagnetische apparaten
Grafeen en kobalt voor het maken van nieuwe elektromagnetische apparaten Ingenuity Mars-helikopter voltooit eerste enkele reis
Ingenuity Mars-helikopter voltooit eerste enkele reis Hoe de kwadratische formule te gebruiken om een kwadratische vergelijking op te lossen
Hoe de kwadratische formule te gebruiken om een kwadratische vergelijking op te lossen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com