
Wetenschap
Scherpste beeld van Alzheimer-fibrillen toont voorheen onbekende details

Een 3D-reconstructie van een amyloïde fibril van twee protofilamenten (rood/blauw) berekend op basis van cryo-elektronenmicroscopiebeelden. Krediet:Forschungszentrum Jülich / HHU Düsseldorf / Gunnar Schröder
Een team van onderzoekers uit Duitsland en Nederland heeft de structuur van een amyloïde fibril bepaald met een tot nu toe onbereikbare resolutie. De fibrillen van het lichaamseigen amyloïde beta-eiwit (Aβ) zijn het hoofdbestanddeel van de afzettingen van herseneiwitten die verband houden met de ziekte van Alzheimer. De driedimensionale structuur op atomair niveau die door de wetenschappers is opgehelderd, onthult voorheen onbekende aspecten van de groei van schadelijke afzettingen en het effect van genetische risicofactoren. De resultaten zijn gepubliceerd in het gerenommeerde tijdschrift Wetenschap .
De structuur laat zien hoe de vele afzonderlijke Aβ-eiwitmoleculen in lagen op elkaar zijn gestapeld en zijn gerangschikt in zogenaamde protofilamenten. Twee van deze protofilamenten zijn om elkaar verstrengeld om een fibril te vormen. Als meerdere van deze fibrillen verstrengeld raken, ze geven aanleiding tot de karakteristieke afzettingen of plaques die worden gedetecteerd in de hersenweefsels van Alzheimerpatiënten.
"Dit is een mijlpaal op weg naar een fundamenteel begrip van amyloïde structuren en gerelateerde ziekten, " zegt prof. Dieter Willbold. "De fibrilstructuur beantwoordt veel vragen over het mechanisme van fibrilgroei en identificeert de rol die wordt gespeeld door een hele reeks familiale mutaties die leiden tot het vroege begin van de ziekte van Alzheimer."
De resolutie van 4 angstrom, overeenkomend met 0,4 nanometer, is binnen de typische grootte van atomaire stralen en atomaire bindingslengtes. In tegenstelling tot eerder werk, het model toont voor het eerst de exacte positie en interacties van de eiwitten. De Aβ-moleculen van de verstrengelde protofilamenten zijn dus niet op hetzelfde niveau, maar als een ritssluiting, ze zijn gespreid met een half interval. Verder, de structuur verheldert voor het eerst de locatie en conformatie van alle 42 aminozuurresiduen van de vele individuele Aβ-eiwitmoleculen.
Deze gedetailleerde structuur biedt een nieuwe basis voor het begrijpen van het structurele effect van een aantal genetische modificaties die het risico op het ontwikkelen van de ziekte vergroten. Ze stabiliseren de fibrillen door de blauwdruk van het eiwit op bepaalde locaties te veranderen. Dit verklaart ook waarom muizen in de natuur geen Alzheimer krijgen, en waarom een klein deel van de IJslandse bevolking min of meer resistent lijkt te zijn tegen de ziekte. Hun varianten van Aβ verschillen door drie of één aminozuurresiduen, respectievelijk, die blijkbaar belangrijk zijn voor de stabiliteit van de fibrillen.
Methodologische diversiteit op het hoogste technologische niveau
In tegenstelling tot de plaques die kenmerkend zijn voor de ziekte die meer dan 100 jaar geleden door Alois Alzheimer werd ontdekt, de nu blootgelegde fibrilstructuur kan niet direct onder de lichtmicroscoop worden waargenomen. Het kostte meer dan een jaar om de gegevens te analyseren die de wetenschappers hadden verkregen met behulp van de cryo-elektronenmicroscopiefaciliteit van de Universiteit Maastricht. Bovendien, metingen met behulp van solid-state nucleaire magnetische resonantie (NMR) spectroscopie en röntgendiffractie-experimenten hielpen het beeld van de fibrilstructuur aan te vullen en volledig te ondersteunen en de verkregen gegevens te valideren.
"De afzonderlijke afbeeldingen in cryo-elektronenmicroscopie zijn meestal extreem luidruchtig, omdat eiwitten erg gevoelig zijn voor elektronenstraling en de afbeeldingen alleen kunnen worden gegenereerd met een zeer lage stralingsintensiteit, " legt Jun.-Prof. Gunnar Schröder uit. Met behulp van een computerondersteunde procedure, hij combineerde duizenden afzonderlijke afbeeldingen en haalde daaruit structurele gegevens met een hoge resolutie.
"Dit is een stap die erg ingewikkeld kan zijn als het monster uit verschillend gevormde fibrillen bestaat. In het verleden, dit was bijna altijd het geval bij de amyloïde fibrillen en vormde een van de belangrijkste obstakels voor de analyse. Echter, we hadden nu een vrij uniek exemplaar met zeer homogene fibrillen - 90 procent van hen had dezelfde vorm en symmetrie, ", zegt Schröder.
Dr. Lothar Gremer slaagde erin het fibrilexemplaar te produceren. "De cruciale stap was om de groei van de fibrillen in het monster sterk te vertragen, van enkele uren tot enkele weken. Daarbij, de individuele Aβ-moleculen kregen genoeg tijd om zich op een zeer uniforme en sterk geordende manier in homogene fibrillen te rangschikken, " zegt Gremer, die het onderzoek heeft geïnitieerd en gecoördineerd.
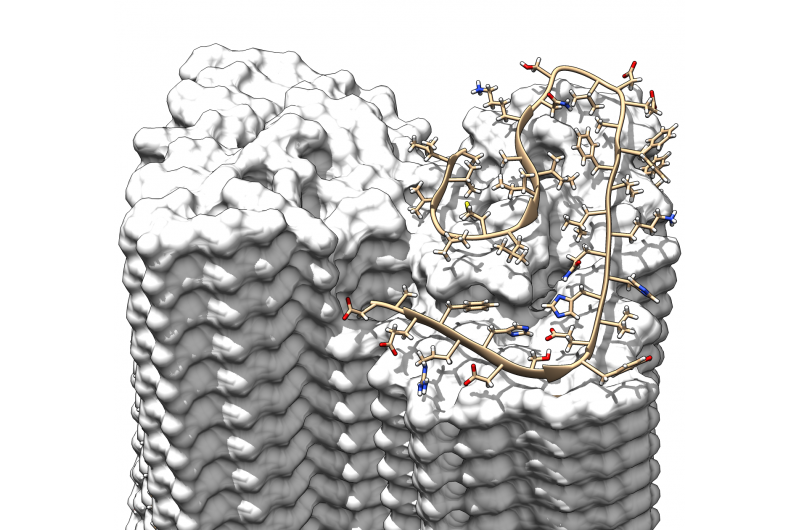
Een dwarsdoorsnede door de fibril die de stapsgewijze overlappende rangschikking van de Aβ-eiwitten illustreert Credit:Forschungszentrum Jülich / HHU Düsseldorf / Gunnar Schröder
Onderzoeken van het fibrilspecimen door middel van solid-state nucleaire magnetische resonantiespectroscopie leverden aanvullende gegevens op om het model te bouwen en hielpen bij het valideren van de structuur. "NMR stelde ons in staat om aanvullende informatie te verkrijgen, zoals welke aminozuurresiduen zoutbruggen vormen, waardoor de stabiliteit van de fibrillen wordt verbeterd, " legt prof. Henrike Heise uit. Röntgendiffractie-experimenten onder supervisie van prof. Jörg Labahn van het Centrum voor structurele systeembiologie in Hamburg bevestigden bovendien de resultaten.
Cryo-elektronenmicroscopie is een relatief nieuwe onderzoeksmethode om de structuur van eiwitmoleculen te bepalen. Vroeger, wetenschappers gebruikten voornamelijk röntgenkristallografie en kernmagnetische resonantiespectroscopie. in 2015, cryo-elektronenmicroscopie werd door het tijdschrift verkozen tot onderzoeksmethode van het jaar Natuurmethoden . Met de al lang bestaande methode van röntgenkristallografie, de eiwitten moeten eerst worden omgezet in een kristallijne vorm, overwegende dat met cryo-elektronenmicroscopie en ook NMR-spectroscopie, de eiwitbouwstenen kunnen in hun natuurlijke staat worden onderzocht. In het geval van cryo-elektronenmicroscopie, de monsters worden eerst opgelost in water, dan flash bevroren, en tenslotte onderzocht met een elektronenmicroscoop. Deze methode heeft bijzondere voordelen als het gaat om het onderzoeken van grote structuren die zijn samengesteld uit honderden of duizenden eiwitten.
De oprichting van een faciliteit voor cryo-elektronenmicroscopie met hoge resolutie zou wetenschappers van Jülich de mogelijkheid kunnen bieden om biologische moleculen te onderzoeken. Naast fundamenteel onderzoek, Jülich's Institute of Complex Systems (ICS-6) ontwikkelt ook een nieuwe behandelingsstrategie met een eigen kandidaat-geneesmiddel.
 Turbulentie-expert onthult kosten klimaatverandering voor luchtvaartverzekeraars
Turbulentie-expert onthult kosten klimaatverandering voor luchtvaartverzekeraars Algoritme biedt systeem voor vroegtijdige waarschuwing voor het volgen van grondwaterverontreiniging
Algoritme biedt systeem voor vroegtijdige waarschuwing voor het volgen van grondwaterverontreiniging Ontwikkelingslanden worden geconfronteerd met stijgende betalingen als gevolg van klimaatverandering, zegt verslag
Ontwikkelingslanden worden geconfronteerd met stijgende betalingen als gevolg van klimaatverandering, zegt verslag Een sprong voorwaarts in het schatten van het waterverbruik van gewassen
Een sprong voorwaarts in het schatten van het waterverbruik van gewassen Welke kleur zijn zandvlooien
Welke kleur zijn zandvlooien
Hoofdlijnen
- Conserveringsonderzoek gebruikt kleine loopbanden om het uithoudingsvermogen van de zeeschildpadden te testen
- Onderzoekers identificeren een paar receptoren die essentieel zijn voor de communicatie tussen mannen en vrouwen bij planten
- Gaan we de zesde grote uitsterving op aarde in?
- Hoe een diercelmodel te maken
- De juiste manier om DNA te repareren
- Genetisch verhogen van de voedingswaarde van maïs kan miljoenen ten goede komen
- Hoe Rigor Mortis te onderscheiden van een Cadaveric Spasm
- Waarin verschillen mensen van onze voorouders?
- Nieuwe ontdekking:gewone kwallen zijn eigenlijk twee soorten
- Ooggestuurde zachte lens maakt de weg vrij voor zachte mens-machine-interfaces
- Voorkom voedselbesmetting met een duurzame coating voor harde oppervlakken

- Wetenschappers zetten de oplossing in een oplosmiddel voor de uitdaging van lithium-zwavelbatterijen
- Agro-industrieel afval kan worden gebruikt als materiaal voor huisvesting en infrastructuur

- Buiswormslijm vertoont langdurige, zelfaangedreven gloed

 Het effect van zonlicht op de tropische savanne
Het effect van zonlicht op de tropische savanne Computercluster berekent zwaartekrachtsgolven sneller dan de vorige supercomputer van het instituut
Computercluster berekent zwaartekrachtsgolven sneller dan de vorige supercomputer van het instituut Studie:Kinderen uit rijkere families voelen meer controle over hun leven
Studie:Kinderen uit rijkere families voelen meer controle over hun leven Genetische redding bevordert het herstel van de met uitsterven bedreigde Australische dwergbuidelmuizen
Genetische redding bevordert het herstel van de met uitsterven bedreigde Australische dwergbuidelmuizen De meest succesvolle startups combineren vriendschappen en zaken om teams te bouwen, onderzoek vindt
De meest succesvolle startups combineren vriendschappen en zaken om teams te bouwen, onderzoek vindt Moeilijk, sterk en hittebestendig:bio-geïnspireerd materiaal ter vervanging van plastic
Moeilijk, sterk en hittebestendig:bio-geïnspireerd materiaal ter vervanging van plastic Hoe mensen nu praten, bevat aanwijzingen over menselijke migratie eeuwen geleden
Hoe mensen nu praten, bevat aanwijzingen over menselijke migratie eeuwen geleden Het vrijkomen van radioactieve deeltjes in Fukushima was significant, zegt nieuw onderzoek
Het vrijkomen van radioactieve deeltjes in Fukushima was significant, zegt nieuw onderzoek
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

