
Wetenschap
Wetenschappers ontdekken structuur van door licht aangedreven enzym met mogelijke toepassingen voor biobrandstof
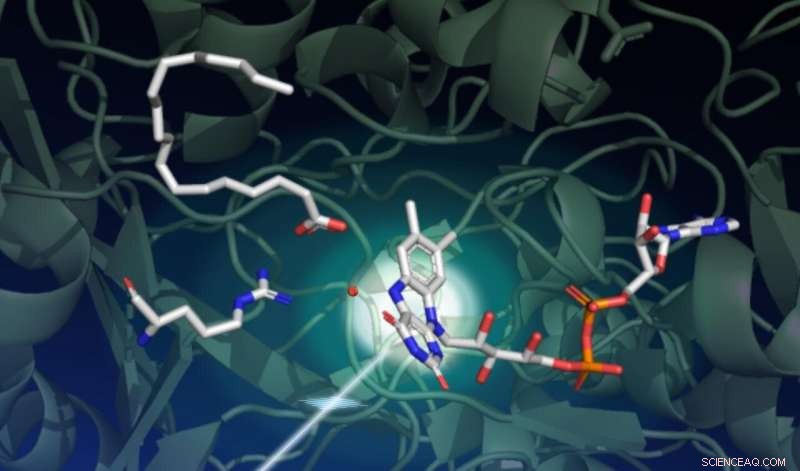
Een onderzoek met SLAC's LCLS-röntgenlaser legde vast hoe licht een reeks complexe structurele veranderingen aanstuurt in een enzym genaamd FAP, die de omzetting van vetzuren in uitgangsbestanddelen voor oplosmiddelen en brandstoffen katalyseert. Deze tekening geeft de begintoestand van de katalytische reactie weer. De donkergroene achtergrond vertegenwoordigt de eiwitsteiger. Het lichtgevoelige deel van het enzym, de FAD-cofactor genoemd, wordt rechts in het midden getoond met zijn drie ringen die een foton absorberen dat van linksonder komt. Linksboven wacht een vetzuur op transformatie. Het aminozuur links in het midden speelt een belangrijke rol in de katalytische cyclus, en de rode stip nabij het midden is een watermolecuul. Krediet:Damien Sorigue/Universite Aix-Marseille
Hoewel veel organismen zonlicht opvangen en erop reageren, enzymen - eiwitten die biochemische reacties katalyseren - worden zelden door licht aangedreven. Wetenschappers hebben tot nu toe slechts drie soorten natuurlijke foto-enzymen geïdentificeerd. De nieuwste, ontdekt in 2017, is vetzuurfotodecarboxylase (FAP). Afgeleid van microscopisch kleine algen, het gebruikt blauw licht om de omzetting van vetzuren te katalyseren, gevonden in vetten en oliën, in alkanen en alkenen.
"Een groeiend aantal laboratoria overweegt FAP's te gebruiken voor groene chemietoepassingen, omdat alkanen en alkenen belangrijke componenten zijn van oplosmiddelen en brandstoffen, inclusief benzine en vliegtuigbrandstoffen. En de transformatie van vetzuren in alkanen of alkenen gebeurt in een enkele stap in het enzym, " zegt Martin Weik, de leider van een onderzoeksgroep aan het Institute of Biologie Structurale aan de Universite Grenoble Alpes.
Weik is een primaire onderzoeker van een nieuwe studie die de complexe opeenvolging van structurele veranderingen heeft vastgelegd die FAP ondergaat als reactie op licht, een fotocyclus genoemd, die deze vetzuurtransformatie aandrijft. Hoewel onderzoekers eerder een FAP-fotocyclus voorstelden, het fundamentele mechanisme werd niet begrepen. De wetenschappers wisten niet hoe lang het duurde voordat een vetzuur zijn carboxylaat verloor, de chemische groep bevestigd aan het einde van zijn lange keten van koolwaterstoffen, een cruciale stap bij het vormen van alkenen of alkanen.
In samenwerking met SLAC-wetenschappers, experimenten bij de Linac Coherent Light Source (LCLS) van het SLAC National Accelerator Laboratory van het Department of Energy hebben geholpen bij het beantwoorden van veel van deze openstaande vragen. De onderzoekers beschrijven hun resultaten in Wetenschap .
Alle tools in een toolbox
Om een lichtgevoelig enzym zoals FAP te begrijpen, wetenschappers gebruiken veel verschillende technieken om processen te bestuderen die plaatsvinden over een breed scala van tijdschalen - omdat fotonenabsorptie plaatsvindt in femtoseconden, of miljoenste van een miljardste van een seconde, terwijl biologische reacties op moleculair niveau vaak in duizendsten van een seconde plaatsvinden.
"Onze internationale, interdisciplinair consortium, onder leiding van Frederic Beisson aan de Université Aix-Marseille, een schat aan technieken gebruikt, inclusief spectroscopie, kristallografie en computationele benaderingen, " zegt Weik. "Het is de som van deze verschillende resultaten die ons in staat hebben gesteld een eerste glimp op te vangen van hoe dit unieke enzym werkt als een functie van tijd en in de ruimte."
Het consortium bestudeerde eerst de complexe stappen van het katalytische proces in hun thuislaboratoria met behulp van optische spectroscopiemethoden, die de elektronische en geometrische structuur van atomen in de monsters onderzoeken, inclusief chemische binding en lading. Spectroscopische experimenten identificeerden de tussenliggende toestanden van het enzym bij elke stap, hun levensduur gemeten en informatie verstrekt over hun chemische aard. Deze resultaten motiveerden de behoefte aan de ultrasnelle mogelijkheden van de LCLS.
Volgende, een structureel beeld van het katalytische proces werd verschaft door seriële femtoseconde kristallografie (SFX) met de LCLS X-ray free-electron laser (XFEL). Tijdens deze experimenten, een straal kleine FAP-microkristallen werd geraakt met optische laserpulsen om de katalytische reactie te starten, gevolgd door extreem korte, ultraheldere röntgenpulsen om de resulterende veranderingen in de structuur van het enzym te meten.
Door duizenden van deze metingen te integreren - verkregen met behulp van verschillende tijdsvertragingen tussen de optische en röntgenpulsen - waren de onderzoekers in staat om structurele veranderingen in het enzym in de loop van de tijd te volgen. Ze bepaalden ook de structuur van de rusttoestand van het enzym door te sonderen zonder de optische laser.
Verrassend genoeg, de onderzoekers ontdekten dat in de rusttoestand, het lichtgevoelige deel van het enzym, de FAD-cofactor genoemd, heeft een gebogen vorm. "Deze cofactor werkt als een antenne om fotonen op te vangen. Hij absorbeert blauw licht en zet het katalytische proces op gang, " zegt Weik. "We dachten dat het startpunt van de FAD-cofactor vlak was, dus deze gebogen configuratie was onverwacht."
De gebogen vorm van de FAD-cofactor werd eigenlijk voor het eerst ontdekt door röntgenkristallografie in de European Synchrotron Radiation Facility, maar de wetenschappers vermoedden dat deze bocht een artefact was van stralingsschade, een veelvoorkomend probleem voor kristallografische gegevens die zijn verzameld bij synchrotron-lichtbronnen. Alleen SFX-experimenten konden deze ongebruikelijke configuratie bevestigen vanwege hun unieke vermogen om structurele informatie vast te leggen voordat het monster wordt beschadigd. zegt Weik.
"Deze experimenten werden aangevuld met berekeningen, " hij voegt toe, "Zonder de hoogwaardige kwantumberekeningen uitgevoerd door Tatiana Domratcheva van de Staatsuniversiteit van Moskou, we zouden onze experimentele resultaten niet hebben begrepen."
Volgende stappen
Ondanks het verbeterde begrip van de fotocyclus van FAP, onbeantwoorde vragen blijven. Bijvoorbeeld, onderzoekers weten dat koolstofdioxide wordt gevormd tijdens een bepaalde stap van het katalytische proces op een specifieke tijd en locatie, maar ze kennen de toestand niet als het het enzym verlaat.
"In toekomstig XFEL-werk, we willen de aard van de producten identificeren en foto's maken van het proces met een veel kleinere stapgrootte om het proces in veel fijner detail op te lossen, ", zegt Weik. "Dit is belangrijk voor fundamenteel onderzoek, maar het kan wetenschappers ook helpen het enzym aan te passen om een taak voor een specifieke toepassing uit te voeren."
 Uitleggen waarom condensatie exotherm is
Uitleggen waarom condensatie exotherm is  Materiaalinformatica onthult nieuwe klasse van superharde legeringen
Materiaalinformatica onthult nieuwe klasse van superharde legeringen De oorzaak van capaciteitsverlies vinden in een metaaloxide batterijmateriaal
De oorzaak van capaciteitsverlies vinden in een metaaloxide batterijmateriaal Wetenschappers gebruiken micro-organismen om functionele bacteriële cellulose in situ te fabriceren
Wetenschappers gebruiken micro-organismen om functionele bacteriële cellulose in situ te fabriceren Hoe kooldioxide uit de lucht te zuigen voor brandstoffen en meer?
Hoe kooldioxide uit de lucht te zuigen voor brandstoffen en meer?
 Invasieve koraalsoorten hebben een verbazingwekkende capaciteit voor regeneratie
Invasieve koraalsoorten hebben een verbazingwekkende capaciteit voor regeneratie Nul netto-uitstoot in 2050:een enorme uitdaging voor de luchtvaartindustrie
Nul netto-uitstoot in 2050:een enorme uitdaging voor de luchtvaartindustrie Het kwantificeren van de ecosysteemdiensten van gletsjers benadrukt hun belang voor de mensheid
Het kwantificeren van de ecosysteemdiensten van gletsjers benadrukt hun belang voor de mensheid Zijn ecobricks het antwoord op plasticvervuiling?
Zijn ecobricks het antwoord op plasticvervuiling? Laagzware bosbranden hebben meer impact op de bodem dan eerder werd aangenomen
Laagzware bosbranden hebben meer impact op de bodem dan eerder werd aangenomen
Hoofdlijnen
- Hoe gender en stereotypen onze relatie met honden kunnen bepalen
- Onderzoekers demonstreren een technische benadering om medicijnen te combineren, controle parasitaire wormen
- Hoe beïnvloedt het hebben van twee van elk soort chromosoom de genen die een persoon heeft?
- Wat is apoptose?
- Stamcelvaccins: de nieuwe grens in kanker-therapie?
- Vleugelstructuur van vitaal belang bij het produceren van een reeks tonen bij paringsoproepen van bush-cricket
- Paranoia zal vernietigen:wanneer overschrijdt gezonde angst de grens in paranoia?
- Gescheiden sinds de dinosauriërs, bamboe-etende lemuren, panda's delen gemeenschappelijke darmmicroben
- Death Valley wordt elke 10 jaar gevuld met wilde bloemen - het gebeurt nu!
- Innovatieve verwerking en verpakking voor veilige, hoge kwaliteit, biologische bessenproducten

- De vier soorten temperatuurschalen

- Franse wetenschappers beweren metallische waterstof te hebben gemaakt
- Uit welke elementen bestaat Zuiveringszout?

- Close-ups van korrelgrenzen onthullen hoe zwavelonzuiverheden nikkel broos maken

 Skunk Water:een wapen dat stank gebruikt om menigten onder controle te houden
Skunk Water:een wapen dat stank gebruikt om menigten onder controle te houden  Virussensing koppelen aan genexpressie, een plant immuunsysteem cursus-corrigeert
Virussensing koppelen aan genexpressie, een plant immuunsysteem cursus-corrigeert Angst groeit voor digitale surveillance:Amerikaans onderzoek
Angst groeit voor digitale surveillance:Amerikaans onderzoek Hoe zien onze klimaatvluchtelingen eruit?
Hoe zien onze klimaatvluchtelingen eruit? Droogte en klimaatverandering waren de aanmaak, en nu staat de oostkust van Australië in vuur en vlam
Droogte en klimaatverandering waren de aanmaak, en nu staat de oostkust van Australië in vuur en vlam Experts waarschuwen dat onstabiele berghelling in Alaska aardverschuivingen en tsunami's met zich meebrengt
Experts waarschuwen dat onstabiele berghelling in Alaska aardverschuivingen en tsunami's met zich meebrengt Hoe te berekenen Momentane Rate
Hoe te berekenen Momentane Rate  Waarom zou ik niet direct na het eten zwemmen?
Waarom zou ik niet direct na het eten zwemmen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com

