Wetenschap
Ontdekking van domino-chemie opent nieuwe grenzen in reactiedynamiek
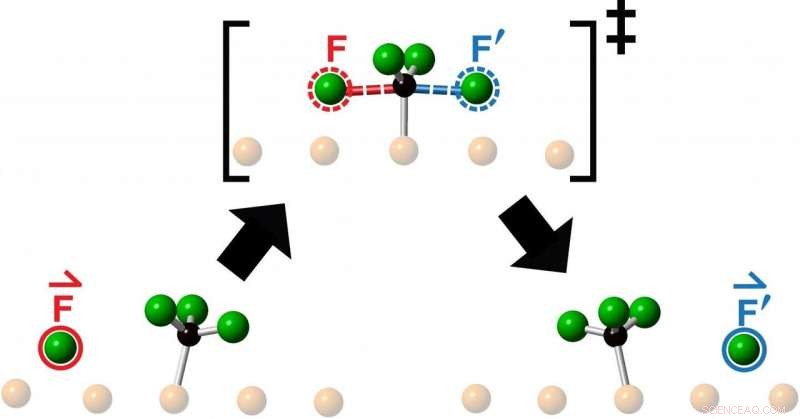
De interpretatie van een kunstenaar van de energiebarrière die een fluoratoom van een reagens moet passeren bij een botsing met een fluormethylmolecuul op weg naar de vorming van een product als gevolg van een chemische reactie. Onderzoekers van de Universiteit van Toronto observeerden de 'knock-on' collineaire uitstoot van het reactieproduct (blauw omcirkeld) in de voortzetting van de richting van het binnenkomende reagensmolecuul (rood omcirkeld). Krediet:Lydie Leung
Onderzoek door een team van chemici aan de Universiteit van Toronto, onder leiding van Nobelprijswinnaar John Polanyi, werpt nieuw licht op het gedrag van moleculen terwijl ze botsen en atomen uitwisselen tijdens chemische reacties. De ontdekking doet twijfel rijzen over een 90 jaar oud theoretisch model van het gedrag van de "overgangstoestand", intermediair tussen reagentia en producten in chemische reacties, het openen van een nieuw onderzoeksgebied.
De onderzoekers bestudeerden botsingen die werden verkregen door een fluoratoom in het midden van een fluormethylmolecuul te lanceren - bestaande uit één koolstofatoom en drie fluoratomen - en observeerden de resulterende reactie met behulp van Scanning Tunneling Microscopy. Wat ze zagen na elke botsing was de uitwerping van een nieuw fluoratoom dat collineair bewoog langs de voortzetting van de naderingsrichting van het binnenkomende fluoratoom.
"Chemici gooien de hele tijd moleculen naar andere moleculen om te zien wat er gebeurt of in de hoop iets nieuws te maken, " zegt Polanyi, Universiteitshoogleraar bij de afdeling Scheikunde van de Faculteit der Kunsten &Wetenschappen aan de U of T en senior auteur van een studie die deze maand is gepubliceerd in Communicatiechemie . "We ontdekten dat het richten van een reagensmolecuul op het centrum van een doelmolecuul, beperkt de beweging van het opkomende product tot een enkele lijn, alsof het product direct 'opgeklopt' is. De verrassende observatie dat het reactieproduct in een rechte lijn naar voren komt, bewegen in dezelfde richting als het binnenkomende reagensatoom, suggereert dat de bewegingen die tot reactie leiden, lijken op een eenvoudige verdere overdracht van momentum.
"Het behoud van lineair momentum dat we hier waarnemen, suggereert een kortstondige 'overgangstoestand', in plaats van de eerdere opvatting dat er voldoende tijd is voor randomisatie van beweging. Newton zou, I denk, zijn verheugd dat de natuur een eenvoudige domino-gebeurtenis toestaat om zoiets complexs als een chemische reactie te beschrijven, ' zegt Polanyi.

Matthew Timm, afgestudeerde student aan de Universiteit van Toronto, bereidt een scanning tunneling-microscoop voor op een experiment dat de uitkomst van een chemische reactie controleert door de impactparameter van moleculaire botsingen te selecteren. Krediet:Diana Tyszko
Het team, waaronder senior onderzoeksmedewerker Lydie Leung, afgestudeerde student Matthew Timm en Ph.D. afgestudeerde Kelvin Anggara, had eerder de middelen ontwikkeld om te controleren of een molecuul dat naar een ander wordt gelanceerd, frontaal botst met zijn doelwit of een gekozen hoeveelheid mist - een hoeveelheid die bekend staat als de impactparameter. Hoe hoger de impactparameter, hoe groter de afstand waarmee het binnenkomende molecuul het doelmolecuul mist. Voor het nieuwe werk de onderzoekers gebruikten een impactparameter van nul om een frontale botsing te geven.
"We noemen dit nieuwe type eendimensionale chemische reactie 'knock-on', aangezien we vinden dat het product wordt aangeklopt langs de voortzetting van de richting van de reagensbenadering, " zegt Polanyi. "De bewegingen lijken op het kloppen van de stalen kogels van een Newtons wieg. De stalen kogels van de wieg gaan niet door elkaar heen, maar efficiënt het momentum langs een enkele lijn overbrengen.
"Evenzo, onze klopreacties dragen energie over langs rijen moleculen, waardoor een kettingreactie wordt bevorderd. Dit behoud van reactie-energie in de dominochemie zou nuttig kunnen zijn als de wereld op weg is naar energiebesparing. Voor nu, het dient als een voorbeeld van een chemische reactie op zijn eenvoudigst."
Het is al meer dan een eeuw bekend dat er een energiebarrière is die chemische reagentia moeten passeren om reactieproducten te vormen. Een geactiveerde overgangstoestand bestaat kort aan de bovenkant van de barrière in een kritieke configuratie - geen overgangstoestand, geen gehoor.
Polanyi zegt dat de observatie van collineaire 'knock-on' inzicht geeft in het reactieve botsingscomplex, die ongeveer een miljoen-miljoenste van een seconde duurt. "Onze resultaten vertellen ons duidelijk dat de overgangstoestand aan de top van de energiebarrière zo kort duurt dat het zijn momentum niet volledig kan doorkruisen. In plaats daarvan, het herinnert zich de richting waaruit het aanvallende fluoratoom kwam."
In de jaren dertig, scheikundigen begonnen de waarschijnlijkheid van het vormen van een overgangstoestand te berekenen in de veronderstelling dat het zijn energie vervormt, als een hete molecuul. Hoewel het een aanname was, het leek goed ingeburgerd en gaf aanleiding tot de statistische "overgangstoestandstheorie" van reactiesnelheden. Dit is nog steeds de favoriete methode voor het berekenen van reactiesnelheden.
"Nutsvoorzieningen, met het vermogen om de reagentia en de producten op moleculair niveau te observeren, men kan precies zien hoe de reagentia benaderen en vervolgens hoe de producten scheiden, ', zegt Polanyi. 'Maar dit druist in tegen het klassieke 90 jaar oude statistische model. Als de energie en het momentum willekeurig waren verdeeld in de hete overgangstoestand, de producten zouden geen duidelijk geheugen van de richting van benadering van de reagentia vertonen. Energie-randomisatie zou werken om dat geheugen te wissen."
De onderzoekers zeggen dat de waargenomen directionele beweging van de reactieproducten de voorkeur geeft aan een deterministisch model van de overgangstoestand om het al lang bestaande statistische model te vervangen. Aanvullend, de waargenomen reactiedynamiek maakt het mogelijk dat de reagensenergie wordt doorgegeven in opeenvolgende collineaire botsingen.
 Een methode om afgebroken perovskiet in zonnecellen te vervangen door ze recyclebaar te maken
Een methode om afgebroken perovskiet in zonnecellen te vervangen door ze recyclebaar te maken Chirurgische instrumenten maken van medisch afval
Chirurgische instrumenten maken van medisch afval Bacteriën groeien in agar
Bacteriën groeien in agar  Afvalwater van olijfmolens getransformeerd:van verontreinigende stof tot bio-meststof, biobrandstof
Afvalwater van olijfmolens getransformeerd:van verontreinigende stof tot bio-meststof, biobrandstof Wetenschappers ontdekken hoe malariaparasieten suiker importeren
Wetenschappers ontdekken hoe malariaparasieten suiker importeren
Hoofdlijnen
- Ecologische successie: definitie, types, stadia en voorbeelden
- Gespecialiseerde cellen in het lichaam
- Het idee testen dat milieu-uitdagingen de evolutie van grotere hersenen stimuleren
- Een epigenetische sleutel om gedragsverandering te ontgrendelen
- Goudvinken blijven jarenlang bij elkaar
- Codominantie: definitie, toelichting en voorbeeld
- Welke landen hebben de kleinste persoonlijke ruimte?
- Pangolin-handel dwingt Ghana om naar nieuwe natuurwetten te kijken
- Een fokprogramma voor natuurbehoud opzetten om de laatste saola te redden
 Onderzoek onthult volledige impact van breuken voor schaliegaswinning
Onderzoek onthult volledige impact van breuken voor schaliegaswinning 6 westerse staten vernietigen plan van Utah om water uit de Colorado-rivier te tappen
6 westerse staten vernietigen plan van Utah om water uit de Colorado-rivier te tappen Drie nieuwe milliseconde pulsars ontdekt in Terzan 5 bolvormige sterrenhoop
Drie nieuwe milliseconde pulsars ontdekt in Terzan 5 bolvormige sterrenhoop Hoe staten van materie in een chemische formule te identificeren
Hoe staten van materie in een chemische formule te identificeren  Typhapes
Typhapes Afbeelding:Modulair experimentplatform op het ISS
Afbeelding:Modulair experimentplatform op het ISS Hoe luchtverontreiniging te meten voor een Science Fair Project
Hoe luchtverontreiniging te meten voor een Science Fair Project  Onderzoekers bedenken nieuwe strategie om naar oude zwarte gaten te zoeken
Onderzoekers bedenken nieuwe strategie om naar oude zwarte gaten te zoeken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com