
Wetenschap
Nieuwe methode voor de ontwikkeling van choline-acetyltransferaseremmers

Krediet:Wiley
Het enzym choline-acetyltransferase (ChAT) katalyseert de synthese van de neurotransmitter acetylcholine en zou een doelwitmolecuul kunnen zijn voor geneesmiddelen. Een Zweeds onderzoeksteam heeft nu het mechanisme bepaald waarmee arylvinylpyridinium (AVP), een bekende klasse van ChAT-remmers, functies. Zoals ze rapporteren in het journaal Angewandte Chemie , ChAT produceert het eigenlijke middel zelf door co-enzym A (CoA) aan AVP te hechten.
Acetylcholine geeft zenuwimpulsen door in synapsen, onder andere. Veranderingen in de hoeveelheid of activiteit van ChAT, die acetylcholine produceert uit choline en acetylco-enzym A (AcCoA), zijn waargenomen bij verschillende ziekten, zoals de ziekte van Alzheimer, schizofrenie, aangeboren verstoring van de signaalgeleiding tussen zenuwen en spieren, en chronische virale infecties. In aanvulling, remming van ChAT zou kunnen dienen als een effectieve behandeling voor vergiftiging door organofosfaatneurotoxinen.
Daten, geschikte ChAT-remmers waren niet beschikbaar. Arylvinylpyridiniumverbindingen (AVP's) waren in vitro goede remmers, maar hun farmacologische profiel bleek inconsistent te zijn. Een team van het Swedish Defense Research Agency en de Universiteit van Umeå (Zweden) onder leiding van Fredrik Ekström is nu in staat om het remmingsmechanisme van AVP's te verduidelijken en inzichten te verschaffen die kunnen worden gebruikt als basis voor de ontwikkeling van ChAT-remmers met een betere effectiviteit en bioactiviteit.
De onderzoekers konden aantonen dat de eigenlijke bioactieve middelen niet de AVP's zelf zijn, maar het adduct dat ze vormen met CoA. De aansluiting van deze twee componenten wordt door ChAT zelf uitgevoerd. Het enzym bouwt zijn eigen remmer uitgaande van een exogene voorloper (AVP) en een endogeen co-substraat (CoA). De reactie is een ongebruikelijke hydrothiolering, die een binding vormt tussen de thiolgroep van het CoA en de vinylgroep van het AVP.
De bindende en katalytische domeinen in ChAT vormen een smalle 'tunnel' die door het enzym gaat. Röntgenkristallografische studies van menselijke ChAT in aanwezigheid van CoA en AVP toonden aan dat het remmende adduct diep in deze tunnel is ingebed. Interacties met hydrofobe pockets nabij de cholinebindingsplaats hebben significante effecten op de sterkte van ChAT-remmers.
De onderzoekers hopen dat hun ontdekkingen de ontwikkeling van nieuwe ChAT-remmers met verbeterde sterkte en duur van activiteit mogelijk zullen maken.
 Kanker op ground zero aanpakken met designer moleculen
Kanker op ground zero aanpakken met designer moleculen Blauw-emitterende diode demonstreert beperkingen en belofte van perovskiet-halfgeleiders
Blauw-emitterende diode demonstreert beperkingen en belofte van perovskiet-halfgeleiders Video:Hoe wordt leer gemaakt?
Video:Hoe wordt leer gemaakt? Een type semi-transparant polymeer dat bij kamertemperatuur kan worden hersteld met een kleine druk
Een type semi-transparant polymeer dat bij kamertemperatuur kan worden hersteld met een kleine druk Een visuele database van menselijke plasmaverbindingen
Een visuele database van menselijke plasmaverbindingen
 Lijst van eetbare waterplanten
Lijst van eetbare waterplanten Hittegerelateerde symptomen troffen een kwart van de Amerikanen in de zomer van 2020
Hittegerelateerde symptomen troffen een kwart van de Amerikanen in de zomer van 2020 Klimaatmodellen herzien met nieuwe aerosolveldgegevens
Klimaatmodellen herzien met nieuwe aerosolveldgegevens De aarde draait de laatste tijd sneller
De aarde draait de laatste tijd sneller Technologie verandert algen van gemeentelijk afvalwater in speciale chemicaliën voor biobrandstoffen, bioplastics
Technologie verandert algen van gemeentelijk afvalwater in speciale chemicaliën voor biobrandstoffen, bioplastics
Hoofdlijnen
- Het voordeel testen van linkshandig zijn in de sport
- Welke vier dingen maken ribosomen anders dan organellen?
- Procedures voor elektroforese van gel
- Wat zijn de functies van microfilamenten en microtubuli?
- Wat kan er gebeuren als Meiose verkeerd gaat?
- Haaien evolueerden vliegtuigachtige attributen om in habitats te passen
- Zou het hebben van een eigen kloon hetzelfde zijn als het hebben van een identieke tweeling?
- Hoe Cytoplasma voor een celproject te maken
- Maak kennis met de oudste dierlijke afstamming van Madagascar, een draaimolenkever met een 206 miljoen jaar oude oorsprong
- Hoe lichaamsbeweging kan helpen bij het bestrijden van drugsverslaving

- Diagnostisch platform kan zich uitbreiden tot het detecteren van biomarkers voor ziekten

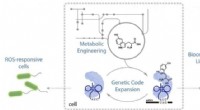
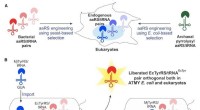
- Chemici breiden genetische code van E. coli uit om 21e aminozuur te produceren, het nieuwe vaardigheden geven
- Hoe kun je engineering studeren aan huis

- Gemanipuleerde genetische machinerie afgeleid van E. coli levert nieuwe aminozuren aan eiwitten
 Een nieuw soort elektronenmicroscopie gebruiken om zwakke van der Waals-interacties te meten
Een nieuw soort elektronenmicroscopie gebruiken om zwakke van der Waals-interacties te meten Als de verwarming aan is, het leren van studenten lijdt
Als de verwarming aan is, het leren van studenten lijdt Welk type lipide wordt geclassificeerd als een ringstructuur?
Welk type lipide wordt geclassificeerd als een ringstructuur?  Honden in de winter beschermen tegen extreme kou, ijs, zout en deicers
Honden in de winter beschermen tegen extreme kou, ijs, zout en deicers Lessen getrokken uit de driftanalyse van MH370-afval
Lessen getrokken uit de driftanalyse van MH370-afval Euclid-telescoop klaar voor extreme ruimteomgeving
Euclid-telescoop klaar voor extreme ruimteomgeving Wanneer Fock Landau ontmoet:topologie in atoom-foton-interacties
Wanneer Fock Landau ontmoet:topologie in atoom-foton-interacties Hoe maak je een 3D-model van een tyfoon
Hoe maak je een 3D-model van een tyfoon
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

