
Wetenschap
Gemanipuleerde genetische machinerie afgeleid van E. coli levert nieuwe aminozuren aan eiwitten
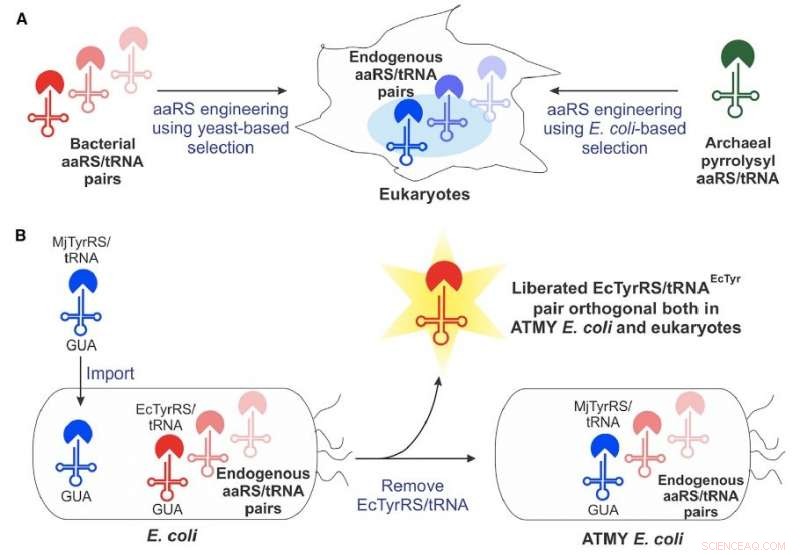
scheikundigen van Boston College hebben een nieuwe, van bacteriën afgeleide technologie om niet-canonieke aminozuren op te nemen in eiwitten van een brede klasse van organismen, inclusief mensen. Krediet:celchemische biologie
Eiwitten - de moleculaire machines die de processen aansturen die ten grondslag liggen aan de biologie - zijn gemaakt van slechts 20 canonieke bouwstenen die aminozuren worden genoemd. Bijna twee decennia lang wetenschappers hebben methoden gezocht om nieuwe aminozuren te ontwikkelen om eiwitten te bouwen.
Een team van scheikundigen van Boston College heeft een technologie ontwikkeld om een reeks nuttige niet-canonieke aminozuren nauwkeurig op te nemen in eiwitten gemaakt in eukaryoten, de brede klasse van hogere organismen die mensen omvat, rapporteerde het team in het journaal Cel Chemische Biologie .
Ongeveer 15 jaar geleden, wetenschappers zagen voor het eerst het potentieel van een geconstrueerde, van bacteriën afgeleide genetische machines - bekend als een aminoacyl-tRNA-synthetase / tRNA-paar - voor het opnemen van niet-canonieke aminozuren in eiwitten die in eukaryote cellen worden geproduceerd. Maar de methode heeft te maken gehad met een aantal technische beperkingen die de wijdverbreide ontwikkeling ervan hebben beperkt.
Het Boston College-team heeft veel van die beperkingen overwonnen door een nieuwe stam van E. coli-bacteriën te ontwikkelen die gemakkelijke engineering van het van bacteriën afgeleide aminoacyl-tRNA-synthetase/tRNA-paar mogelijk maakt, volgens universitair docent scheikunde Abhishek Chatterjee, die het project leidde. Deze nieuwe benadering maakte de opname van verschillende niet-canonieke aminozuren mogelijk, waaronder p-boronofenylalanine, in eiwitten geproduceerd in menselijke cellen en in de gemanipuleerde stam van E coli .
Chatterjee zei dat het team verrast was door de faciliteit van de nieuwe aanpak, die wordt beschreven in het nieuwe rapport "Resurrecting the bacteriële tyrosyl-tRNA synthetase/tRNA pair for expansion the genetic code of both E coli en eukaryoten."
"Deze roman maken E coli stam vereist vervanging van zijn natieve aminoacyl-tRNA synthetase/tRNA-paar met een tegenhanger van een ander organisme, waarvan we verwachtten dat het erg moeilijk zou zijn, " zei hij. "Maar het bleek heel haalbaar. Dat opent deze complete technologie."
Chatterjee zei dat het team probeerde een nieuwe methode te ontwikkelen om eiwitfuncties te ontwikkelen en te controleren als een manier om het wetenschappelijke begrip van de processen die eiwitfuncties in onze cellen sturen, uit te breiden.
"Duizenden eiwitten zijn gecodeerd in het genoom die ons maken tot wie we zijn, maar we weten heel weinig over dat proces, ' zei Chatterjee. 'In menselijke cellen, er zijn er ongeveer 20, 000 eiwitcoderende genen. Wat ze doen en hoe ze het doen, blijft moeilijk te bestuderen. Een van de grootste problemen is dat als je wilt weten wat ze doen, je moet ze bespioneren. Je moet een sonde aansluiten die kan rapporteren wat er aan de hand is."
Het introduceren van dergelijke sondes is moeilijk gebleken, omdat het proces vaak het doeleiwit beschadigt.
In welke cel dan ook, eiwitten zijn gemaakt van 20 aminozuren - een vaste groep die op volgorde wordt geleid door genetische instructies.
"Het idee is dat we een nieuwe bouwsteen in eiwitten kunnen introduceren die de natuur niet heeft - naast de 20 canonieke aminozuren die de natuur gebruikt, ' zei Chatterjee. 'Als we dat kunnen, we hebben de mogelijkheid om heel specifiek een breed scala aan niet-natuurlijke functionaliteiten te introduceren op elke plaats van vrijwel elk eiwit."
Het directe voordeel zou zijn om onderzoekers te helpen die nog steeds de mysteries van celbiologie en eiwitfunctie ontrafelen.
"Je zou een eiwit kunnen maken met een niet-canoniek aminozuur op elke gekozen plaats, laad het met sondes die erg klein zijn en een optisch signaal afgeven dat vertelt waar het naartoe gaat, " Zei Chatterjee. "Het zou je in staat kunnen stellen om te manipuleren hoe het eiwit werkt. Je zou limieten kunnen invoeren, dus wat het eiwit ook doet, het kan niet meer. En je zou de sonde kunnen verwijderen door een extern signaal zoals licht te gebruiken. Deze technologie opent tal van nieuwe manieren om de eiwitfunctie te onderzoeken en te ontwikkelen, wat anders een hele uitdaging zou zijn."
 Wat is er aan de hand als overgangen tussen een vaste stof, een vloeistof en een gas?
Wat is er aan de hand als overgangen tussen een vaste stof, een vloeistof en een gas?  Frontale polymerisatie afstemmen op diverse materiaaleigenschappen
Frontale polymerisatie afstemmen op diverse materiaaleigenschappen Wat zou de snelheid van diffusie van een molecuul door een membraan kunnen beïnvloeden?
Wat zou de snelheid van diffusie van een molecuul door een membraan kunnen beïnvloeden?  Typen lijm gebruikt in OSB
Typen lijm gebruikt in OSB  DNA-schade veroorzaakt door migrerende lichtenergie
DNA-schade veroorzaakt door migrerende lichtenergie
 Uitdunnen van bossen, voorgeschreven vuur vóór droogte verminderde boomverlies
Uitdunnen van bossen, voorgeschreven vuur vóór droogte verminderde boomverlies Wateren in het loofbos
Wateren in het loofbos  Beroemde theorie van de levende aarde geüpgraded naar Gaia 2.0
Beroemde theorie van de levende aarde geüpgraded naar Gaia 2.0 Trump klaar om klimaatbescherming terug te draaien
Trump klaar om klimaatbescherming terug te draaien Het in kaart brengen van diepe riffen levert waardevolle gegevens op voor onderzoekers, natuurbeschermers
Het in kaart brengen van diepe riffen levert waardevolle gegevens op voor onderzoekers, natuurbeschermers
Hoofdlijnen
- Bang voor spinnen? Het kan in je DNA zitten
- Drie mechanismen van genetische recombinatie in Prokaryotes
- Familiebanden Snapper leveren nieuw bewijs op over mariene reservaten
- Wat gebeurt er in de interfase van de celcyclus?
- blootstelling aan bomen, de lucht en het gezang van vogels in steden gunstig voor het geestelijk welzijn
- Wat gebeurt er op een microscopisch niveau tijdens homeostase?
- Make-up en wetenschap Eerlijke ideeën
- Bron van Beperking Enzymes
- Wetenschappers en boeren werken samen om Afrikaans liefdegras uit te roeien
 Kleine satellieten klaar om grote bijdragen te leveren aan essentiële wetenschap
Kleine satellieten klaar om grote bijdragen te leveren aan essentiële wetenschap Hoe de hoogte van een driehoek te vinden
Hoe de hoogte van een driehoek te vinden  Een openbare database van macromoleculaire diffractie-experimenten
Een openbare database van macromoleculaire diffractie-experimenten Baanbrekende infraroodcamera geeft het scherpste beeld ooit van sterren en planeetvormende schijven
Baanbrekende infraroodcamera geeft het scherpste beeld ooit van sterren en planeetvormende schijven Natuurkundigen komen dichter bij het onderzoeken van de symmetrieën die ten grondslag liggen aan ons universum
Natuurkundigen komen dichter bij het onderzoeken van de symmetrieën die ten grondslag liggen aan ons universum Met de eerste Mars-monsters verpakt, Doorzettingsvermogen initieert opmerkelijke voorbeeldretourmissie
Met de eerste Mars-monsters verpakt, Doorzettingsvermogen initieert opmerkelijke voorbeeldretourmissie Antarctica:een laboratorium voor klimaatverandering
Antarctica:een laboratorium voor klimaatverandering Na een verbluffende groeireeks, Amazon-ambities lijken grenzeloos
Na een verbluffende groeireeks, Amazon-ambities lijken grenzeloos
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com






