
Wetenschap
Wetenschappers onthullen dubbele specificiteit van Vav2-SH2-eiwit
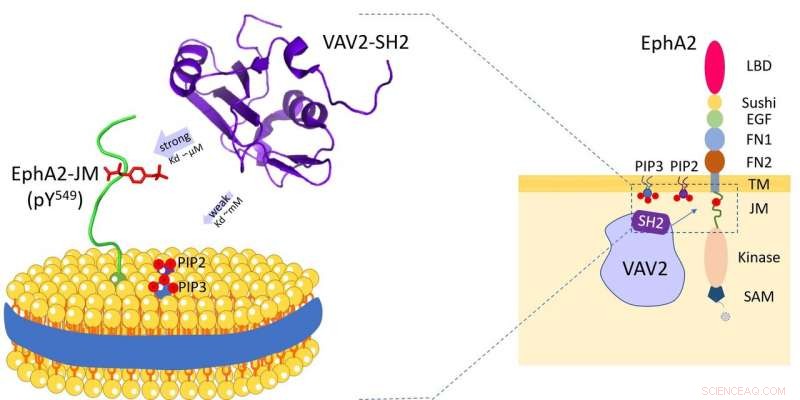
Vav2-eiwit bindt aan celmembraanfosfolipiden en het receptortyrosinekinase EphA2-juxtamembraangebied. Krediet:HFIPS
Onlangs, een onderzoeksteam onder leiding van Prof. Wang Junfeng van het High Magnetic Field Laboratory, Hefei Institutes of Physical Science onthulden de dubbele specificiteit van Vav2-SH2-eiwit na onderzoek van het specifieke herkenningsmechanisme van menselijk Vav2-eiwit met celmembraanfosfolipiden en het receptortyrosinekinase EphA2-juxtamembraangebied.
Vav2 komt breed tot expressie in menselijke weefsels en speelt een essentiële rol in verschillende biologische processen. En via zijn Src-homology 2 (SH2) domein, Vav2 kan interageren met verschillende transmembraanreceptoren. Deze SH2-gemedieerde interacties vinden plaats op of nabij het plasmamembraan en zijn essentieel voor Vav2 om verschillende extracellulaire signaaltransductie te mediëren.
In dit onderzoek, met behulp van nucleaire magnetische resonantie (NMR) technieken, de onderzoekers ontdekten de rol van de fosfolipide dubbellaagse omgeving op eiwit-eiwit interactie, biedt een potentiële methode om deze interactie in dezelfde omgeving onder bijna fysiologische omstandigheden te bestuderen.
De onderzoekers onthulden dat het Vav2-SH2-domein specifiek bond aan het Y594-gefosforyleerde juxtamembraangebied met behulp van de geconserveerde eiwitbindingsplaats. interessant, het had ook het fosfolipide-bindende vermogen en de fosfolipide-bindende plaats van Vav2-SH2, grenzend aan de eiwitbindingsplaats, werd bepaald door NMR-experimenten.
Verder, de onderzoekers gebruikten lipide nanodiscs om het membraan na te bootsen, en ontdekte de rol van de membraanomgeving bij het moduleren van deze eiwit-eiwitherkenning.
 Hot brew koffie heeft een hoger gehalte aan antioxidanten dan cold brew
Hot brew koffie heeft een hoger gehalte aan antioxidanten dan cold brew Een nieuwe procedure voor het verkrijgen van een goedkope, ultrahard materiaal dat bestand is tegen radioactiviteit
Een nieuwe procedure voor het verkrijgen van een goedkope, ultrahard materiaal dat bestand is tegen radioactiviteit Fotosynthese versus cellulaire ademhaling in elektronenstroom
Fotosynthese versus cellulaire ademhaling in elektronenstroom Nieuwe aanpak verbetert het vermogen om metaalreacties met water te voorspellen
Nieuwe aanpak verbetert het vermogen om metaalreacties met water te voorspellen Wetenschappers maken kunstmatige katalysatoren geïnspireerd door levende enzymen
Wetenschappers maken kunstmatige katalysatoren geïnspireerd door levende enzymen
 Hoe je auto microplastics in de oceaan werpt, duizenden kilometers verderop
Hoe je auto microplastics in de oceaan werpt, duizenden kilometers verderop Hoe de eigenaar van een homing-duif te vinden
Hoe de eigenaar van een homing-duif te vinden Hoe de rook van bosbranden de wereld rondreist
Hoe de rook van bosbranden de wereld rondreist Aangezien China snel schone energie toepast, gebruik van traditionele kachels blijft bestaan
Aangezien China snel schone energie toepast, gebruik van traditionele kachels blijft bestaan Groenland wordt donkerder, warmer naarmate de sneeuw ouder wordt en van vorm verandert
Groenland wordt donkerder, warmer naarmate de sneeuw ouder wordt en van vorm verandert
Hoofdlijnen
- Techniek op de plaats delict die wordt gebruikt om schildpadden te volgen
- Het type weefsel dat de Bodys-structuren ondersteunt en vasthoudt
- Australische hagedissen eisen tol van schildpadeieren
- Gewassen evolueerden 10 millennia eerder dan gedacht
- Inktvissen horen boeggolf van dreigend gevaar
- Gist brengt genetische variaties in de schijnwerpers die verband houden met resistentie tegen geneesmiddelen
- Wetenschap verklaart de kleur van je kerst
- Evolutionaire relaties tussen prokaryoten en eukaryoten
- Drie voorbeelden van protisten met wetenschappelijke namen
- Efficiënte perovskiet-zonnecellen ontwikkeld door interface-gemedieerde recombinatie te verminderen
- Wetenschappers hebben een ongrijpbare verwarde knoop van DNA opgespoord
- Beheersing van stromen vloeibaar metaal bij kamertemperatuur
- Muriatinezuur neutraliseren

- Chemici maken thermohardend polymeer met behulp van amine en triketon dat recyclebaar is
 PCA Nursing Math-problemen
PCA Nursing Math-problemen  Hoe Covalent Compounds
Hoe Covalent Compounds Renault sluit belangrijkste Chinese bedrijf, zal zich richten op elektriciteit
Renault sluit belangrijkste Chinese bedrijf, zal zich richten op elektriciteit Hoe het Panamakanaal het water bergop laat stromen
Hoe het Panamakanaal het water bergop laat stromen  Moleculaire klitten:peptiden begeleiden zelfassemblage op micrometerschaal
Moleculaire klitten:peptiden begeleiden zelfassemblage op micrometerschaal Snelle en gemakkelijke experimenten met magneten
Snelle en gemakkelijke experimenten met magneten Afvalwater omzetten in een hulpbron
Afvalwater omzetten in een hulpbron Hoe de pakkingsfractie van een diamantrooster te berekenen
Hoe de pakkingsfractie van een diamantrooster te berekenen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Danish | Norway | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

