
Wetenschap
Bacterieel cellulose-afbraaksysteem kan de productie van biobrandstoffen stimuleren
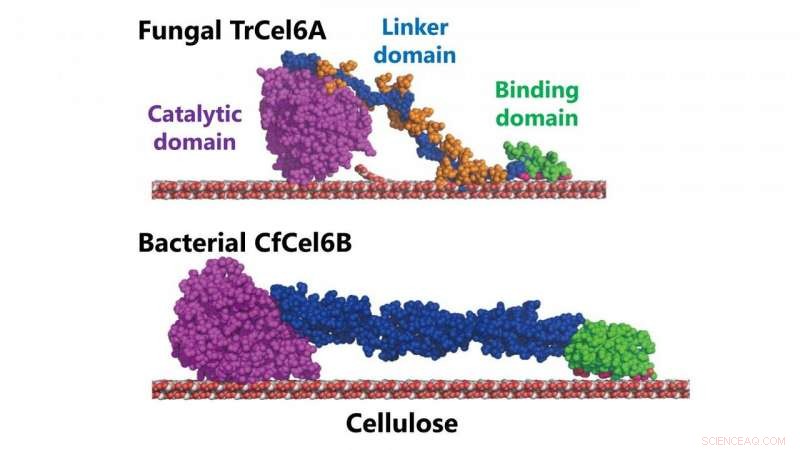
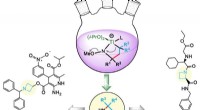
Structurele modellen van schimmel- en bacteriële cellobiohydrolasen (TrCel6A, CfCel6B) Krediet:NINS/IMS
Inspanningen om manieren te vinden om cellulose - het harde materiaal waaruit de celwanden van planten bestaan - sneller en productiever af te breken, zijn al lang een doel van industriële onderzoekers.
Wanneer planten worden verwerkt tot biobrandstoffen of andere biomassatoepassingen, cellulose moet eerst worden afgebroken tot eenvoudigere suikermoleculen, en deze stap kan tot een kwart van de bedrijfs- en kapitaalkosten van de productie van biobrandstoffen vertegenwoordigen. Als dit proces sneller en productiever kan worden gemaakt, het zal niet alleen de industrie geld besparen, maar dergelijke efficiëntieverbeteringen kunnen ook de milieu-impact van de productie verminderen.
Cellulosemoleculen binden zeer sterk aan elkaar, waardoor cellulose zeer moeilijk afbreekbaar is. Sommige schimmels kunnen het afbreken, echter, en hun celluloseafbraaksystemen zijn algemeen bekend.
Schimmels produceren vele soorten cellulasen -enzymen die de chemische reactie versnellen die cellulose afbreekt. En om deze reden worden dergelijke schimmels veel gebruikt in de industrie. Bijvoorbeeld, de schimmel Trichoderma reesei -ontdekt tijdens de Tweede Wereldoorlog in de Stille Oceaan als gevolg van het wegvreten van tenten en kleding - wordt gebruikt bij de productie van stone-washed jeans. Cellobiohydrolase , een type cellulase dat de schimmel produceert, breekt cellulose af tot cellobiose, een eenvoudige suiker die gemakkelijker door organismen kan worden gebruikt. Hierdoor wordt het denimmateriaal op sommige plaatsen enigszins aangetast, wat het op zijn beurt verzacht - waardoor het lijkt alsof het met stenen is gewassen - en het comfortabeler maakt om te dragen.
Maar er is een ander type cellulose-afbraaksysteem dat door sommige bacteriën wordt gebruikt, en die in veel opzichten vergelijkbaar is met die van deze schimmel. Maar dit systeem is tot nu toe niet erg goed begrepen. In een krant in de Tijdschrift voor biologische chemie op 18 augustus, onderzoekers van het Japanse Instituut voor Moleculaire Wetenschappen, Nationale instituten voor natuurwetenschappen (IMS, NINS) hebben dit systeem eindelijk in detail beschreven op het niveau van één molecuul.
Het type cellobiohydrolase dat door de bacterie wordt geproduceerd Cellulomonas fimi heeft een soortgelijk katalytisch domein als het cellobiohydrolase geproduceerd door T. reesei . Het katalytische domein van een enzym is het gebied dat een interactie aangaat met een molecuul dat het wil veranderen of afbreken (om de enzymatische reactie te veroorzaken). Zowel de schimmel als het cellulose-afbraaksysteem van de bacterie vertonen ook een vergelijkbare hydrolytische activiteit (de manier waarop ze water gebruiken om de chemische bindingen van de cellulose af te breken).
Maar de twee systemen hebben verschillende koolhydraatbindende modules (de reeks eiwitten in het enzym die zich binden aan de koolhydraten in de cellulose) en zogenaamde "linkers", in wezen het deel van het enzym dat het katalytische domein verbindt met de koolhydraatbindende modules.
Bij eerder onderzoek is de NINS-wetenschappers hadden al vastgesteld dat de structuur van het linkergebied van het schimmelcellobiohydrolase een cruciale rol speelde in hoe snel het enzym bindt aan cellulose (en dus hoe snel het systeem cellulose afbreekt).
"Dus de voor de hand liggende volgende vragen waren:hoewel deze andere delen van het cellobiohydrolase van de bacterie anders zijn dan die van de schimmel, doen ze toch iets soortgelijks?" zeiden Akihiko Nakamura en Ryota Iino, de onderzoekers in het team. "Versnellen ze ook de afbraak van cellulose?"
Ze ontdekten dat ze dat doen. De wetenschappers gebruikten fluorescentiebeeldvorming met één molecuul - een geavanceerde methode van microscopie die beelden van levende cellen levert met een resolutie van slechts tientallen nanometers - om de cellobiohydrolase van de bacterie te zien binden aan en dissociëren van cellulosemoleculen.
Dit stelde hen in staat om de functies van de verschillende delen van het cellulose-afbraaksysteem te verduidelijken. Ze ontdekten dat de koolhydraatbindende modules inderdaad belangrijk waren voor de initiële binding, maar de rol die het linkergebied speelde was vrij klein.
Echter, ze ontdekten dat het katalytische domein toch niet zo vergelijkbaar was. De structuur vertoonde langere lussen bij de ingang en uitgang van een "tunnel" in het hart van het systeem in vergelijking met die van de schimmel. En dit verschil in de tunnelstructuur resulteert in een hogere processiviteit - het vermogen van een enzym om meerdere opeenvolgende reacties te veroorzaken.
De volgende stappen zullen zijn om deze bacteriële cellulose-afbrekende enzymen te ontwikkelen om cellulose sneller af te breken.
 Het delen van gegevens is de toekomst van materiaalonderzoek
Het delen van gegevens is de toekomst van materiaalonderzoek Afluisteren van afzonderlijke moleculen met licht door het gebabbel opnieuw af te spelen
Afluisteren van afzonderlijke moleculen met licht door het gebabbel opnieuw af te spelen Onderzoeker verdiept zich in plaque-veroorzakende eiwitten bij ALS en dementie
Onderzoeker verdiept zich in plaque-veroorzakende eiwitten bij ALS en dementie Onderzoek details regulering van een multi-drug transporter
Onderzoek details regulering van een multi-drug transporter Zuur kan een belangrijk ingrediënt zijn voor een betere kleefkracht, elektronische componenten
Zuur kan een belangrijk ingrediënt zijn voor een betere kleefkracht, elektronische componenten
 Angst en zweten in de heetste steden van Pakistan
Angst en zweten in de heetste steden van Pakistan In Irmas pad, Haïtianen trotseren stormen alleen
In Irmas pad, Haïtianen trotseren stormen alleen Meer landen dan ooit getroffen door bosbranden in 2018
Meer landen dan ooit getroffen door bosbranden in 2018 NASA ziet tropische cycloon 02S zich ontwikkelen in de Zuidelijke Indische Oceaan
NASA ziet tropische cycloon 02S zich ontwikkelen in de Zuidelijke Indische Oceaan De uitstoot van lachgas kan erger worden naarmate het klimaat warmer wordt
De uitstoot van lachgas kan erger worden naarmate het klimaat warmer wordt
Hoofdlijnen
- Wetenschappers roepen de VS op om onderzoek naar potmedicijnen voor huisdieren toe te staan
- De voordelen van de beperking van off-road voertuigen wegen zwaarder dan de kosten voor de nationale kust
- Chloroplast: definitie, structuur en functie (met diagram)
- Chimpstudie onthult hoe de hersenstructuur onze evolutie heeft gevormd
- Neuron: definitie, structuur, functie en types
- Hinderlaag in een petrischaal
- Neanderthalers waren eigenlijk prehistorische Picasso's
- Hoe ziet een menselijke cel eruit?
- Colombia - een megadivers paradijs dat nog ontdekt moet worden
- De nieuwe alchemie in koolstofneutraliteit:water omzetten in ammoniak met alleen hernieuwbare energie
- Atoomstructuur onthult hoe cellen omgevingssignalen vertalen
- Apparaten voor hoge temperaturen gemaakt van films die buigen als ze ademen

- Directe omzetting van roestig roestvrijstalen gaas in stabiel, goedkope elektroden voor kalium-ionbatterijen
- Chemici laten zien dat zijn heup vierkant is
 Apple verkoopt een nieuwe batterijbehuizing voor zijn nieuwste iPhones ... voor $ 129
Apple verkoopt een nieuwe batterijbehuizing voor zijn nieuwste iPhones ... voor $ 129 Profilering van extreme bundels:wetenschappers bedenken nieuwe diagnostiek voor geavanceerde en next-gen deeltjesversnellers
Profilering van extreme bundels:wetenschappers bedenken nieuwe diagnostiek voor geavanceerde en next-gen deeltjesversnellers Afbeelding:Een handig laboratorium in de ruimte
Afbeelding:Een handig laboratorium in de ruimte Brandweerlieden bestrijden brand in Californië die zijn eigen weer genereert
Brandweerlieden bestrijden brand in Californië die zijn eigen weer genereert Googley betekent niet jong, Google claimt in rechtszaak over leeftijdsvooroordelen
Googley betekent niet jong, Google claimt in rechtszaak over leeftijdsvooroordelen Studie onderzoekt mechanisme van klaring van nanomateriaal door lever
Studie onderzoekt mechanisme van klaring van nanomateriaal door lever Kunstmatige huid kan helpen bij revalidatie en virtual reality verbeteren
Kunstmatige huid kan helpen bij revalidatie en virtual reality verbeteren Hoe wordt actieve kool in poedervorm gebruikt?
Hoe wordt actieve kool in poedervorm gebruikt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Portuguese | Swedish | Dutch | Danish | Norway | French | Spanish | German |

-
Wetenschap © https://nl.scienceaq.com

