
Wetenschap
Studie onderzoekt mechanisme van klaring van nanomateriaal door lever
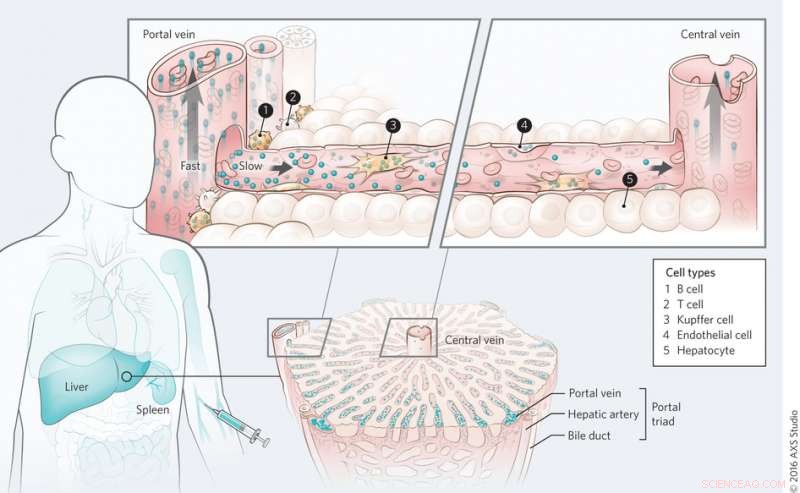
Mechanisme van transport van nanomateriaal in de lever. Krediet:(c) Kim M. Tsoi, et al. Natuurmaterialen (2016) doi:10.1038/nmat4718
(Phys.org) — Een van de grootste uitdagingen om het potentieel van gerichte therapieën te realiseren, is om te voorkomen dat nanomaterialen zich ophopen in de lever of milt. De lever en de milt maken deel uit van het mononucleaire fagocytsysteem. Het is zijn taak om gifstoffen uit de bloedbaan te filteren. Helaas, bij het doen van zijn werk, het verhindert ook dat nanotherapieën hun doel bereiken.
Om dit obstakel te overwinnen, heeft een groep onderzoekers van verschillende instellingen in Toronto computationele, in vitro, en in vivo studies met behulp van kwantumstippen, gouden nanodeeltjes, en silica-nanodeeltjes om het mononucleaire fagocytsysteem en het mechanisme waarmee nanodeeltjes worden afgezonderd beter te begrijpen. Ze ontdekten dat de bloedstroomsnelheid, cellulair fenotype, en fysieke positie in de lever spelen allemaal een rol bij de opname van nanodeeltjes. Ze suggereren dat toekomstig werk niet alleen betrekking moet hebben op het ontwerpen van nanodeeltjes, maar een soort van pre-conditionering van de lever. Hun werk verschijnt in Natuurmaterialen .
Nanodeeltjes kunnen zodanig worden gefunctionaliseerd dat het deeltje zich richt op een bepaald celtype. Dit belooft veel voor kanker en andere gerichte therapieën. Echter, wanneer nanotherapieën in het lichaam worden getest, het nanodeeltje wordt via het mononucleaire fagocytensysteem (MPS) uit de bloedbaan verwijderd. Dit geldt voor alle soorten nanodeeltjes.
Tsoi, et al. analyses van hele organen en suborganen uitgevoerd om beter te begrijpen hoe het MPS-systeem nanodeeltjes sequestreert. Voor hun experimenten, ze richtten zich op niet-afbreekbare "harde" nanodeeltjes:kwantumdots, gouden nanodeeltjes, en silica nanodeeltjes.
Op het hele orgelniveau Tsoi, et al. ontdekte dat kwantumstippen eerst worden gewist door de cellen in de buurt van de portal-triade en dat er een klaringsgradiënt is door de leversinusoïde tijdens de eerste doorgang. Bloed stroomt de lever binnen via de portale triade en stroomt naar buiten via de centrale ader. Dit werd ook waargenomen met gouden nanodeeltjes, ongeacht de functionalisering van het oppervlak, hoewel eiwitadsorptie een rol leek te spelen bij de opname van nanodeeltjes.
Het volgende onderzoeksgebied is of de bloedstroomsnelheid een rol speelt bij de opslag van nanodeeltjes. De bloedstroom vertraagt zodra het de lever bereikt (van 10-100 cm s -1 tot 200-800 m s -1 ). Tsoi, et al. ontwikkelde een wiskundig model om de bloedstroom in de lever en de waarschijnlijkheid van vastlegging van nanodeeltjes te beschrijven. Vervolgens vergeleken ze hun computationele resultaten met de resultaten van cytometriestudies met de ratten die werden behandeld met kwantumstippen in de test voor accumulatie van nanodeeltjes. Opmerkelijk, terwijl advectie de dominante invloed is op de bloedstroom in het lichaam, diffusie is de dominante invloed in de lever. Ze ontdekten dat de lever 10 2 tot 10 3 maal meer kans om nanomaterialen te sekwestreren en dat de deeltjesgrootte een rol speelde – hoe groter het deeltje, hoe groter de kans dat het door de lever werd opgenomen.
Op het niveau van het suborgaan Tsoi, et al. gekeken welke celtypen de grootste rol spelen bij de opname van nanodeeltjes. Studies om de opname van kwantumdots door cellen te bepalen, toonden aan dat Kupffer-cellen het grootste volume aan kwantumdots adsorbeerden, zoals verwacht. Echter, wat verrassend was, was het aantal deeltjes dat door B-cellen werd geïnternaliseerd. B-cellen lijken een veel grotere rol te spelen bij de opname van nanodeeltjes dan ooit werd gedacht, hoewel Kupffer-cellen nog steeds de belangrijkste cellen zijn bij het verwijderen van nanodeeltjes. Andere celtypes, inclusief endotheelcellen, speelde ook een rol bij het verwijderen van nanodeeltjes.
Volgende, Tsoi, et al. getest of orgaanarchitectuur de opname van nanodeeltjes in de lever beïnvloedt door het sequestratieproces in de milt te bestuderen. Ze vonden dat van de nanodeeltjes die door de milt werden verwijderd, bijna allemaal bevonden ze zich in het rode pulpgebied. Dit is waar de bloedstroom afneemt in vergelijking met de stroom door het lichaam. Terwijl sommige nanodeeltjes zich in de milt bevonden, miltmacrofagen internaliseerden minder nanodeeltjes dan Kupffer-cellen in de lever. Dit werd bevestigd met vergelijkende in vitro en in vivo studies, en toont aan dat het celtype van de orgaanarchitectuur een rol speelt bij de opname van nanodeeltjes.
Dit onderzoek biedt belangrijke inzichten in hoe de opname van nanodeeltjes door de MPS kan worden tegengegaan. Doorgaans richten onderzoekers zich op het ontwerp van nanodeeltjes, maar deze studie suggereert dat de lichaamsomgeving een belangrijke rol speelt bij de opslag van nanodeeltjes. De auteurs stellen voor om de hostomgeving te manipuleren als een aanvullende strategie voor optimalisatie van nanodeeltjes. Voorlopige tests tonen aan dat er twee mogelijke manieren zijn om de bloedstroom door de lever te veranderen en het fenotype van bepaalde cellen te veranderen, zodat ze niet vatbaar zijn voor opname van nanomateriaal.
© 2016 Fys.org
 Biologische voedingsmiddelen verifiëren
Biologische voedingsmiddelen verifiëren Wetenschappers betrappen planten terwijl ze de chemie veranderen, waarvan gedacht wordt dat ze onveranderlijk zijn omdat ze noodzakelijk zijn voor het leven
Wetenschappers betrappen planten terwijl ze de chemie veranderen, waarvan gedacht wordt dat ze onveranderlijk zijn omdat ze noodzakelijk zijn voor het leven Een nieuwe dimensie voor batterijen
Een nieuwe dimensie voor batterijen Een superresolutieweergave van chemische reacties
Een superresolutieweergave van chemische reacties Waarom explodeert Soda wanneer u menthi toevoegt?
Waarom explodeert Soda wanneer u menthi toevoegt?
 Kleine ijsverliezen aan de randen van Antarctica kunnen het ijsverlies ver weg versnellen
Kleine ijsverliezen aan de randen van Antarctica kunnen het ijsverlies ver weg versnellen Rechtszaak:3M-besmetting leidde tot meer kanker, onvruchtbaarheid
Rechtszaak:3M-besmetting leidde tot meer kanker, onvruchtbaarheid Regenbuien doven bosbranden in Oost-Australië
Regenbuien doven bosbranden in Oost-Australië De drie soorten omgevingsaanpassingen
De drie soorten omgevingsaanpassingen  Australiërs gevangen door bosbranden verteld te laat om te vertrekken
Australiërs gevangen door bosbranden verteld te laat om te vertrekken
Hoofdlijnen
- "What Does Heterozygous Mean?
- Menselijke schedelgroei
- Nieuwe studie benadrukt de effecten van een wereldwijde strategie om de antibioticaconsumptie in de productie van voedseldieren te verminderen
- Twee studies vinden dat stress cellen herprogrammeert
- Hoe maak je een dierencel uit Candy
- Zijn kinderen gelukkiger dan volwassenen?
- De terugkeer van wolven naar Oregon brengt conflicten en kansen
- Science Fair-projecten met nagellak
- Tasmaanse tijger gedoemd lang voordat er mensen kwamen
- Een schakelaar die het verkeer over bloedvaten regelt
- Gevoelige nano-oscillator kan ziekteverwekkers detecteren
- Magnetische nanodeeltjes vergemakkelijken de verwijdering van microverontreinigingen uit afvalwater

- Wetenschappers scherpen de grootte en omgevingsinvloed aan van de kwantumstippen die worden gebruikt in hybride zonnecellen
- Slaapliedje voor nano-piano's kan een doorbraak in de opslag betekenen
 Onderzoekers meten afzonderlijke atomen in een grafeen-petrischaal
Onderzoekers meten afzonderlijke atomen in een grafeen-petrischaal Voorbeelden van niet-mengbare vloeistoffen
Voorbeelden van niet-mengbare vloeistoffen Daycare Cleaning Checklist
Daycare Cleaning Checklist  Waarom zijn mensen religieus? Een cognitief perspectief
Waarom zijn mensen religieus? Een cognitief perspectief Terwijl Tesla ronddraait, Ford en GM krijgen geen liefde van Wall Street
Terwijl Tesla ronddraait, Ford en GM krijgen geen liefde van Wall Street Grootste gletsjers Groenlands smelten waarschijnlijk sneller dan gevreesd:studie
Grootste gletsjers Groenlands smelten waarschijnlijk sneller dan gevreesd:studie Teslas Autopilot ingeschakeld tijdens crash in Utah
Teslas Autopilot ingeschakeld tijdens crash in Utah NASA's Aqua-satelliet legt brandwonden vast van Substation Fire
NASA's Aqua-satelliet legt brandwonden vast van Substation Fire
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

