
Wetenschap
Atoomstructuur onthult hoe cellen omgevingssignalen vertalen
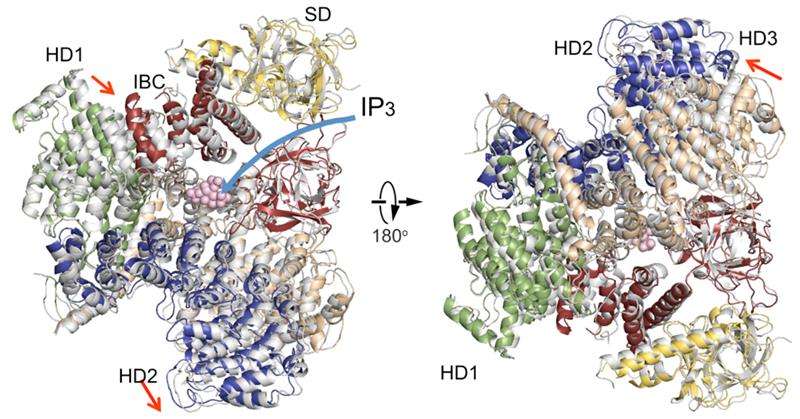
Een vergelijking van IP3R cytosolische domeinstructuren in afwezigheid van IP3 (gekleurd) met één in aanwezigheid van IP3 (grijs). Domein organisatie. Suppressor-domein (SD), geel; IP3-bindingskern (IBC), rood; spiraalvormig domein 1 (HD1), groente; spiraalvormig domein 2 (HD2), blauw; spiraalvormig domein 3, tarwe. Krediet:RIKEN
Onderzoekers van het RIKEN Brain Science Institute hebben de atomaire resolutiestructuur bepaald van een sleutelmolecuul dat signalen uit de lokale omgeving van een cel vertaalt in een taal die de cel kan begrijpen en gebruiken. De bepaling van de architectuur van de Inositol Tris-Phosphate Receptor (IP3R) werd lange tijd beschouwd als een belangrijk doel in biomedisch onderzoek vanwege zijn strategische rol in cellen als een moleculair treinstation voor het overbrengen van signalen die veel celfuncties regelen.
Het hoogtepunt van een inspanning van bijna 10 jaar, onderzoekers hebben de atomaire resolutiestructuur bepaald van een sleutelmolecuul dat signalen uit de lokale omgeving van een cel vertaalt in een taal die de cel kan begrijpen en gebruiken. De bepaling van de architectuur van de Inositol Tris-Phosphate Receptor (IP3R) werd lange tijd beschouwd als een belangrijk doel in biomedisch onderzoek vanwege zijn strategische rol in cellen als een moleculair treinstation voor het overbrengen van signalen die veel celfuncties regelen. De structuur zal naar verwachting bijdragen aan de ontwikkeling van betere therapeutische benaderingen voor veel ziekten. Het werk werd uitgevoerd door een team van het RIKEN Brain Science Institute onder leiding van professor Katsuhiko Mikoshiba, wiens laboratorium het eerste IP3R-gen in 1989 kloonde.
In alle levende cellen chemische signalen worden gebruikt voor intracellulaire communicatie. De inositol 1, 4, 5-trisfosfaat (IP3) is zo'n signaal dat bindt aan de IP3-receptor (IP3R) om calciumionen (Ca2+) vrij te maken uit intracellulaire Ca2+-voorraden zoals het endoplasmatisch reticulum. De in IP3R ingebedde Ca2+-opslagplaatsen zijn verdeeld over verschillende microdomeinen binnen cellen en spelen een centrale rol in processen die zo divers zijn als neurale communicatie, differentiatie, plasticiteit, en stofwisseling. Van de drie geïdentificeerde genen, het door de hersenen dominante type 1 IP3R (IP3R1) is genetisch de oorzaak van spinocerebellaire ataxie 15/16/29 en het syndroom van Gillespie, en reguleert cellulaire afvalverwijderingsprocessen die betrokken zijn bij de etiologie van neurodegeneratieve ziekten, waaronder de ziekte van Alzheimer. Hoewel de belangrijke rol van IP3R in normale en ziektetoestanden bekend is, begrijpen hoe IP3-signalen de opening van het Ca2+-kanaal activeren, was ongrijpbaar.
De nieuwe IP3R1-kristalstructuur onthult een rijke kosmos van details op atomaire schaal over zijn functie. IP3R1 is een micromachine met een diameter van 20 nm die twee functionele substructuren bevat, een IP3-bindingsplaats en een Ca2+-kanaalporie. De afstand van de IP3-bindingsplaats tot de kanaalporie is 7 nm, de langste van vergelijkbare ionkanalen, en de fundamentele vraag hoe IP3-binding fysiek het kanaal van een lange afstand opent, is in de decennia sinds het gen werd gekloond onbeantwoord gebleven. Röntgenkristallografie van het grote cytosolische domein van een muis IP3R1 in de afwezigheid en aanwezigheid van IP3, in de RIKEN SPring-8 ionenbundelfabriek, identificeerde een langeafstandsmechanisme met een IP3-afhankelijke globale beweging van een deel van de receptor, het kromming--helixdomein genaamd, dat dient als een brug tussen de cytosolische en kanaaldomeinen. Mutagenese van deze brug onthulde de essentiële rol van een folderstructuur in het α-helixdomein dat IP3-signalen doorgeeft aan het kanaal, en kan helpen verklaren hoe lange-afstandskoppeling van IP3-binding aan het Ca2+-kanaal plaatsvindt.
De bevindingen onthullen overeenkomsten en verschillen met een recent gepubliceerd rapport over de IP3R met behulp van een geheel andere methode genaamd cryo-elektronenmicroscopie. In de verwante studie, een groep onder leiding van Irina Serysheva van het Health Science Center van de Universiteit van Texas in Houston stelde voor dat kanaalactivering door IP3 kan plaatsvinden door directe binding van de C-terminus en het IP3-bindende domein en koppeling van het IP3-bindende domein aan naburige subeenheden. De huidige gegevens zijn het niet eens met deze conclusies, in plaats daarvan suggereert dat de IP3-bindingsplaats aan het bladgebied ten grondslag ligt aan de dynamische structurele veranderingen door IP3. Een vergelijking van de twee structuren onthult overeenstemming over een onbeweeglijk deel van het spiraalvormige domein van de kromming en een variabele rangschikking van andere spiraalvormige domeinen. De auteurs veronderstellen dat de immobiele sectie zou fungeren als een star lichaam dat een koppel van IP3-bindingsplaatsen naar het kanaaldomein leidt, terwijl de flexibele regio's zouden bijdragen aan de dynamische eigenschappen van de IP3R-functie.
Het oplossen van het al lang bestaande mysterie van langeafstandscommunicatie waarmee IP3 het kanaal kan openen, zal bijdragen aan toekomstig rationeel medicijnontwerp gericht op de receptor, wat een meer diverse reeks therapeutische wegen mogelijk zou kunnen maken. De bevindingen kunnen ook de rol van IP3R in cellulaire senescentie en tumoronderdrukking verduidelijken die verband houdt met selectieve kwetsbaarheid van kankercellen. Verrassend genoeg, de studie verduidelijkt ook een rol van IP3R's in de functie van pathogene eencellige organismen zoals Trypanosoma cruzi, de parasiet van de ziekte van Chagas, en bruce, die Afrikaanse trypanosomiasis of slaapziekte veroorzaakt. Het team identificeerde een aminozuursequentie in de bijsluiter die wordt bewaard in parasieten, suggereert structurele inzichten die kunnen helpen bij het ontdekken van medicijnen voor deze verwoestende aandoeningen.
 Tyfoons en andere rampen dwingen Japan om zijn plannen voor de toekomst van stad versus platteland te heroverwegen
Tyfoons en andere rampen dwingen Japan om zijn plannen voor de toekomst van stad versus platteland te heroverwegen Verbetering van waterkracht door langdurige droogtevoorspellingen
Verbetering van waterkracht door langdurige droogtevoorspellingen Onderzoek op nationale schaal toont aan dat invasieve grassen natuurbrand bevorderen
Onderzoek op nationale schaal toont aan dat invasieve grassen natuurbrand bevorderen Bereid je voor op het ergste:10 stappen om je voor te bereiden op wildvuurrook
Bereid je voor op het ergste:10 stappen om je voor te bereiden op wildvuurrook De opwarming van de aarde bestrijden met blauwe koolstof
De opwarming van de aarde bestrijden met blauwe koolstof
Hoofdlijnen
- Wetenschappers bundelen hun krachten om Puerto Ricos Monkey Island te redden
- Wat kan je spit je vertellen over je DNA?
- Wat zijn de functies van mRNA & tRNA?
- Sumatraanse tijgers op weg naar herstel in gevaar UNESCO-werelderfgoed
- Onderzoek wijst uit dat gezinsvriendelijke viaducten nodig zijn om grizzlyberen te helpen
- Hoe reproduceren algen?
- Sommige apen die vatbaar zijn voor isolatie
- Mosquito-seks-eiwit kan de sleutel zijn tot het beheersen van ziekten
- Hoe de gecorrigeerde WBC-telling te berekenen
- Wetenschappers produceren hoogwaardig gips volledig uit afval

- Klein worden om te bepalen waar nucleair materiaal vandaan komt en hoe het is gemaakt

- Bioactief boraatglas op nanoschaal:een materiaal van de volgende generatie voor huidgenezing

- Niet-invasieve diagnose van prostaatkanker, toezicht houden

- Een nikkelkatalysator met koolwaterstoffen gebruiken om vetzuren te maken

 Het belang van water in zaden Kiemkracht
Het belang van water in zaden Kiemkracht  Kustprocessen verbinden met mondiale systemen
Kustprocessen verbinden met mondiale systemen Het meten van de magnetische velden op de heetste planeten in de melkweg
Het meten van de magnetische velden op de heetste planeten in de melkweg Wetenschappers ontdekken grote kloof in het laatste bastion van dik zee-ijs in de Noordpool
Wetenschappers ontdekken grote kloof in het laatste bastion van dik zee-ijs in de Noordpool De veiligheid van de bestuurder verbeteren:een gestandaardiseerde kijk op afleidingsmonitoren
De veiligheid van de bestuurder verbeteren:een gestandaardiseerde kijk op afleidingsmonitoren Microlitter:een uitdaging voor afvalwaterzuiveringsinstallaties
Microlitter:een uitdaging voor afvalwaterzuiveringsinstallaties De eerste on-chip vallei-afhankelijke kwantuminterferentie
De eerste on-chip vallei-afhankelijke kwantuminterferentie Wetenschappers schetsen de fundamenten van een kolonie op Mars
Wetenschappers schetsen de fundamenten van een kolonie op Mars
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Spanish | Portuguese | German | Dutch | Danish | Norway | French | Italian | Swedish |

-
Wetenschap © https://nl.scienceaq.com

