
Wetenschap
Wetenschappers analyseren structuur, mechanisme van faageiwit dat elektronen steelt
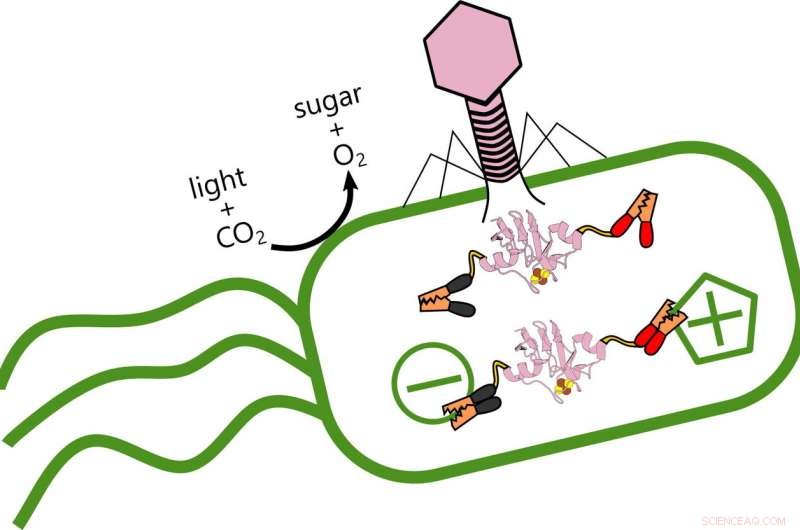
Rijstwetenschappers analyseren de rol van ferredoxine-eiwitten die worden geproduceerd wanneer virale fagen de elektronenoverdracht in de oceaan veranderen, fotosynthetische bacteriën die zuurstof produceren en koolstof opslaan. Wanneer het virus (roze) de bacteriën infecteert, het produceert een ferredoxine-eiwit dat in de bestaande elektrische structuur van de bacterie haakt en het metabolisme verandert. Krediet:Ian Campbell
Onder het oppervlak van de oceaan, een virus kaapt het metabolisme van het meest voorkomende organisme op aarde. Dat kan interessant zijn voor degenen onder ons die ademen.
Wetenschappers van Rice University analyseerden de rol van ferredoxine-eiwitten die worden geproduceerd wanneer fagen het vermogen van Prochlorococcus marinus om koolstof op te slaan veranderen en het broeikasgaseffect als gevolg van het verbruik van fossiele brandstoffen tegengaan.
P. marinus is een fotosynthetische cyanobacteriën die voornamelijk in de tropen en subtropen voorkomt, waar naar schatting 10 tot 27 (een octiljoen) van hen zonlicht gebruiken om zuurstof te produceren en gezamenlijk vier gigaton koolstof per jaar op te slaan. Een deel van deze koolstof levert kritische grondstoffen voor andere mariene organismen.
Maar fagen zijn niet hun vrienden. Het virus versterkt zichzelf door energie te stelen die de bacteriën uit licht produceren, het herprogrammeren van het genoom van het slachtoffer om te veranderen hoe het elektronen overdraagt.
P. marinus en zijn koolstofopslagmechanisme zijn temperatuurgevoelig, dus het moet toekijken hoe klimaatverandering de oceanen verwarmt en zijn bereik uitbreidt, zei Ian Campbell, een postdoctoraal onderzoeker van Rice en hoofdauteur van de studie in de Tijdschrift voor biologische chemie .
"De groei in het verspreidingsgebied van dit organisme in de oceanen zou de totale hoeveelheid koolstof die door deze microben wordt opgeslagen, kunnen vergroten, "zei hij. "Als alternatief, de virussen die deze bacteriën infecteren, kunnen de koolstoffixatie veranderen en mogelijk voorkomen dat gigaton koolstof jaarlijks uit de lucht wordt gehaald, volgens een recente projectie."
Campbell zei dat het doel van het onderzoek was om de verschillende manieren waarop virussen met hun gastheren omgaan te onderzoeken. In het proces, de onderzoekers ontdekten dat de faag de controle over de elektronenstroom in de gastheer zelf ontneemt, herbedrading van het metabolisme van de bacteriën. "Als het virus infecteert, het stopt de productie van de bacteriële eiwitten en vervangt het door zijn eigen varianten, " zei hij. "Ik vergelijk het met het plaatsen van een ander besturingssysteem in een computer."
De onderzoekers gebruikten synthetische biologietechnieken om faag- en cyanobacteriële eiwitten te mixen en matchen om te bestuderen hoe ze op elkaar inwerken. Een deel van de studie onder leiding van Rice-biochemicus George Phillips bepaalde ook voor de eerste keer de structuur van een belangrijk cyanofaag-ferredoxine-eiwit.
"Een faag zou normaal gesproken een cel binnengaan en alles doden, " zei Rice synthetisch bioloog Jonathan Silberg, de hoofdwetenschapper van de studie en directeur van Systems van de universiteit, Programma Synthetische en Fysische Biologie.
"Maar de resultaten van Ian suggereren dat deze fagen een complex controlemechanisme opzetten, "zei hij. "Ik zou niet zeggen dat ze hun gastheren zombificeerden, omdat ze de cellen in staat stellen een deel van hun eigen huishouding te blijven doen. Maar ze pluggen ook hun eigen ferredoxines in, zoals stroomkabels, om de elektronenstroom te verfijnen."
In plaats van direct met cyanofagen en P. marinus te werken, Campbell en zijn team gebruikten synthetische biologietools om veel grotere, beter begrepen Escherichia coli-bacteriën om genen tot expressie te brengen die interacties tussen de twee nabootsten.
"Een faag en een cyanobacteriën uit de oceaan nemen en proberen de biologie te bestuderen, vooral elektronenstroom, zou heel moeilijk zijn om te doen door middel van klassieke biochemie, Silberg zei. "Ian nam letterlijk partners van zowel de faag als de gastheer, ze samenbrengen door hun DNA in een ander cellulair systeem te coderen, en was in staat om snel enkele interessante resultaten te ontwikkelen.
"Het is een interessante toepassing van synthetische biologie om complexe dingen te begrijpen die anders moeilijk te meten zouden zijn, " hij zei.
De onderzoekers vermoeden dat het eiwit dat ze hebben gemodelleerd in E. coli, de Prochlorococcus P-SSM2 faag ferredoxine, is niets nieuws. "Mensen wisten dat fagen coderen voor verschillende dingen die elektronenoverdracht doen, maar ze wisten niet hoe ze de draden tussen de faag en de gastheer moesten verbinden, " zei Silberg. "Ze wisten ook niet veel over de evolutie van de faag. De structuur maakt duidelijk dat deze faag kan worden herleid tot specifieke voorouderlijke eiwitten die betrokken zijn bij fotosynthese."
 Laboratoriumglaswerk en -functies
Laboratoriumglaswerk en -functies  De chemische samenstelling van uitgeademde lucht van menselijke longen
De chemische samenstelling van uitgeademde lucht van menselijke longen Mechanochemische vorming van peptidebindingen achter de oorsprong van het leven
Mechanochemische vorming van peptidebindingen achter de oorsprong van het leven Hoe reinigt wasmiddel oppervlaktespanning?
Hoe reinigt wasmiddel oppervlaktespanning?  Organisch afval gebruiken om bodemverontreiniging door zware metalen tegen te gaan
Organisch afval gebruiken om bodemverontreiniging door zware metalen tegen te gaan
 Wat doen wijnmakers met druivenafval?
Wat doen wijnmakers met druivenafval?  Aanwijzingen van vulkanische explosies in het verleden helpen het team toekomstige activiteiten te modelleren
Aanwijzingen van vulkanische explosies in het verleden helpen het team toekomstige activiteiten te modelleren Behandeld hydraulisch brekend afvalwater kan waterbronnen in de omgeving jarenlang vervuilen
Behandeld hydraulisch brekend afvalwater kan waterbronnen in de omgeving jarenlang vervuilen De bodem kan antibiotica uit gezuiverd afvalwater filteren, grondwater beschermen
De bodem kan antibiotica uit gezuiverd afvalwater filteren, grondwater beschermen Experts vinden de oorsprong van Europa's klimaat verborgen in garnalenschelpen
Experts vinden de oorsprong van Europa's klimaat verborgen in garnalenschelpen
Hoofdlijnen
- Gebruik je echt maar 10 procent van je hersenen?
- Vereiste chemische reacties om homeostase te handhaven
- Belang van diffusie in organismen
- Video:Op weg naar nul honger wereldwijd
- Middeleeuwse kist levert fascinerend skelet op
- Wetenschappers tonen moleculaire basis voor mieren die als lijfwachten voor planten fungeren
- Wat kan albatrospoep ons vertellen over klimaatverandering?
- RNA-ontdekking kan de plantwarmte helpen verhogen, droogtetolerantie
- Wat zijn de functies van een levercel?
- Levensrijk patroon:onderzoekers gebruiken geluid om de toekomst van printen vorm te geven

- Een als door te bewerken, twee als door wegversperring:menselijk eiwit bestrijdt HIV als monomeer en dimeer
- Surround sound van lichtgewicht roll-to-roll bedrukt luidsprekerpapier

- Synthetische verbinding zorgt voor snelle screening op potentiële medicijnen
- Ontdekken hoe T-cellen het SARS-COV-2 virus spike-eiwit herkennen
 Ervan uitgaande dat gemakkelijke koolstofverwijdering uit de atmosfeer een gok met hoge inzetten is, wetenschappers zeggen:
Ervan uitgaande dat gemakkelijke koolstofverwijdering uit de atmosfeer een gok met hoge inzetten is, wetenschappers zeggen: Bittere kou in januari zal het ongedierte in de veldgewassen waarschijnlijk niet verminderen
Bittere kou in januari zal het ongedierte in de veldgewassen waarschijnlijk niet verminderen Studie onthult een nieuw uniform coatingproces van p-ALD
Studie onthult een nieuw uniform coatingproces van p-ALD Beving in Alaska toont complexiteit van tsunami-waarschuwingen
Beving in Alaska toont complexiteit van tsunami-waarschuwingen Vegas Tourism Board steunt $ 49 miljoen Elon Musk-transitsysteem
Vegas Tourism Board steunt $ 49 miljoen Elon Musk-transitsysteem Apparaten van stroom voorzien - met een bureaulamp?
Apparaten van stroom voorzien - met een bureaulamp? Het lichtste licht - de toekomst van digitale displays en hersenwetenschap
Het lichtste licht - de toekomst van digitale displays en hersenwetenschap Medicijnen ontwerpen die gericht zijn op een ander deel van de levenscode
Medicijnen ontwerpen die gericht zijn op een ander deel van de levenscode
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

