
Wetenschap
Nieuwe röntgenmethode heeft ingrijpende gevolgen voor de ontwikkeling van levensreddende medicijnen
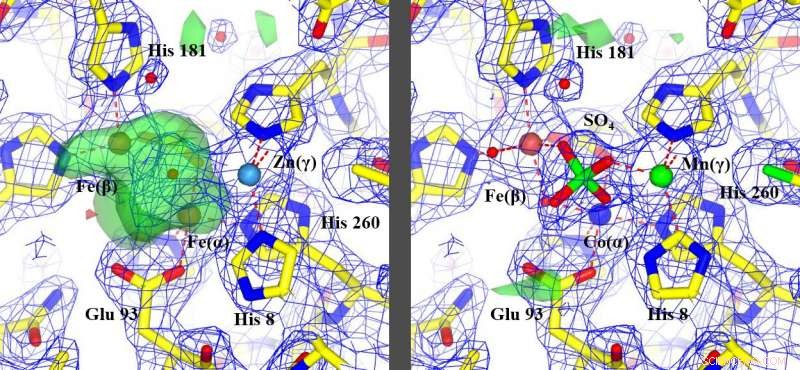
De nieuwe methode, het corrigeren van de verkeerd geïdentificeerde metalen, toegestaan herinterpretatie van niet-geïdentificeerde kenmerken, groen gemarkeerd, (afbeelding links) om te zien hoe het eiwit werkte, (afbeelding rechts). Credit:Edward Snell
Eiwitten die metaal bevatten, bekend als metalloproteïnen, spelen een belangrijke rol in de biologie, reguleren van verschillende routes in het lichaam, die vaak het doelwit worden van levensreddende medicijnen. Hoewel de hoeveelheid metaal in dergelijke eiwitten meestal klein is, het is cruciaal om de functie van deze complexe moleculen te bepalen.
Wetenschappers weten al lang dat metalloproteïnen essentieel zijn voor het begrijpen van ziekten, zoals kanker, en voor het ontwikkelen van nieuwe geneesmiddelen, aangezien remmers van metalloproteïnen zijn gebruikt voor de behandeling van ziekten van kanker en HIV/AIDS tot bacteriële infecties en hypertensie. Maar er is geen betrouwbare, analytische methode voor het bepalen van de identiteit en hoeveelheid metaalatomen in metalloproteïnen.
Nutsvoorzieningen, in een studie die vorige maand werd gepubliceerd in de Tijdschrift van de American Chemical Society , een internationaal team van onderzoekers meldt dat ze een manier hebben ontwikkeld om op een efficiënte en routinematige manier metaalatomen in eiwitten eenduidig te identificeren en te tellen. Het gebruiken, het team - waaronder wetenschappers van de universiteit van Buffalo, Hauptman-Woodward Medical Research Institute en anderen hebben nieuwe informatie onthuld die er was, maar eerder verborgen.
Deeltje-geïnduceerde emissie van röntgenstralen genoemd, of PIXE, de methode werd voor het eerst ontwikkeld in de jaren negentig door Elspeth F. Garman van de Universiteit van Oxford en Geoffrey W. Grime van de Universiteit van Surrey Ion Beam Centre, beide auteurs op het huidige papier.
De doorbraak die in het huidige artikel wordt gerapporteerd, is de ontwikkeling van de methode naar een efficiënte high-throughput-aanpak en de combinatie met andere experimentele gegevens om het type en de nauwkeurige positie van de metalen in de eiwitten te identificeren. Hierdoor kunnen veel verschillende soorten eiwitten, grote aantallen vormen het leven zoals we dat kennen, snel en efficiënt te analyseren, en geeft nieuwe informatie voor een beter structureel begrip.
Het team paste de nieuwe methode toe op 30 willekeurig geselecteerde metalloproteïnen, die zich al in de wereldwijde opslagplaats van eiwitstructuren bevinden, de Protein Data Bank. Wat er daarna gebeurde schokte hen.
'Het resultaat was verbluffend'
"Ik zat in Buffalo met mijn medewerker uit Oxford en toen we de cijfers kraakten, we realiseerden ons allebei meteen dat we een ontdekking hadden gedaan, " herinnerde Edward Snell zich, doctoraat, een van de corresponderende auteurs, die president en CEO is van Hauptman-Woodward en professor in de afdeling Materials Design and Innovation, een gezamenlijk programma van UB's School of Engineering and Applied Sciences en haar College of Arts and Sciences. "We hebben de cijfers omgezet in een afbeelding en verborgen in de gegevens was een uitleg van hoe deze moleculaire machine werkte.
"We waren de eersten ter wereld die zagen wat zich daar altijd had verstopt. Het resultaat was verbluffend."
De resultaten toonden aan dat de methoden die eerder werden gebruikt om enkele van deze 30 willekeurige eiwitstructuren te bepalen, het metaalatoom verkeerd hadden geïdentificeerd of, in sommige gevallen, het helemaal gemist.
"Volgens onze resultaten, de huidige kennis van ongeveer de helft van de onderzochte monsters is onjuist, ' zei Snel.
De onderzoekers merkten op dat de Protein Data Bank een cruciale bron is voor onderzoekers over de hele wereld. in 2017, er waren alleen al in de VS gemiddeld 1,86 miljoen downloads per dag. Ze constateren dat een enorm aantal onderzoekers structuren uit de databank gebruikt zonder kennis te hebben van de mogelijke fundamentele fouten die aanwezig kunnen zijn.
En momenteel, meer dan 30% van de databankmodellen bevat een metaal.
Diepgaande implicaties
"Extrapoleren van onze resultaten waarin er een verkeerd geïdentificeerd metaal was in ten minste de helft van de bestudeerde monsters, suggereert dat meer dan 350, 000 gedownloade modellen per dag bevatten mogelijk niet het juiste metaal, " zei Snell. "Dit heeft ingrijpende gevolgen voor degenen die de modellen gebruiken. Als deze modellen fout zijn, het begrip van de miljoenen mensen die ze gebruiken wordt gebrekkig."
Snell legde uit dat een van de moeilijkheden bij het bestuderen van metalen in eiwitten is dat ze erg gevoelig zijn voor röntgenstraling, dus het experiment zelf kan veranderen wat je ziet. Maar hij merkte op, een techniek die gebruik maakt van X-Ray Free Electron Lasers (XFEL's), voorkomt dit omdat de experimenten meestal sneller zijn dan welke verandering dan ook die kan optreden.
Snell leidt de National Science Foundation BioXFEL Science and Technology Center, (Biology with X-ray Free Electron Lasers) een consortium van UB, Hauptman-Woodward en hun partners. Het centrum is gewijd aan het gebruik van XFEL's, die ongelooflijk intense röntgenstralen produceren in extreem korte pulsen, en kan helpen bij het nauwkeurige begrip van deze metalen in biologische systemen.
Op basis van zijn ervaring met Hauptman-Woodward's high-throughput kristallisatiescreeningcentrum, Snell werkte samen om de PIXE-techniek te implementeren in een omgeving met hoge doorvoer. Hij gebruikte zijn kennis van röntgeneigenschappen om te identificeren dat er nieuwe structurele informatie in de gegevens aanwezig was en nam die kennis vervolgens om in een structureel resultaat.
"In principe, mijn collega's identificeerden de metalen en ons werk in Buffalo liet ze zien waar ze ze moesten plaatsen, het onthullen van de nieuwe informatie die beschikbaar kwam toen het metaal in het model correct was, " hij zei.
 Draadloos oplaadbare solid-state supercondensatoren printen voor zachte, slimme contactlenzen
Draadloos oplaadbare solid-state supercondensatoren printen voor zachte, slimme contactlenzen Een geweldige nieuwe manier om 3D-geprinte objecten te schilderen
Een geweldige nieuwe manier om 3D-geprinte objecten te schilderen Mistharp vergroot opvangcapaciteit voor schoon water
Mistharp vergroot opvangcapaciteit voor schoon water Defect grafeen heeft een hoge elektrokatalytische activiteit
Defect grafeen heeft een hoge elektrokatalytische activiteit Verschillende manieren om de pH van drinkwater te verhogen
Verschillende manieren om de pH van drinkwater te verhogen
Hoofdlijnen
- Virussen bestrijden:codebrekers worden codeschrijvers
- Minder gewassen voeden wereldwijd meer mensen - en dat is niet goed
- Goudvinken blijven jarenlang bij elkaar
- Waarom is UV-licht schadelijk?
- Landen in de Stille Oceaan kunnen door klimaatverandering 50 - 80% van de vis in lokale wateren verliezen
- Links of rechts? Net als mensen, bijen hebben een voorkeur
- Metabolisme heeft een directe invloed op de kans op het ontwikkelen van malaria
- Genen die mensen scheiden van fruitvliegen gevonden
- Is diepgevroren kabeljauw net zo lekker als vers?
- Mini-centrifuge voor eenvoudigere studie van bloedcellen opent nieuwe organ-on-chip mogelijkheden

- Klaar voor zijn close-up - een bacterietransportroute voor elektronen
- Lesgeven in CRISPR en antibioticaresistentie aan middelbare scholieren

- Grote doorbraak in de productie van rode bloedcellen
- Benchmarks om de zon beter te vangen

 Weide van dansende slangsterren toont evolutie aan het werk
Weide van dansende slangsterren toont evolutie aan het werk Vier manieren waarop sociale-mediaplatforms de verspreiding van haatdragende inhoud in de nasleep van terreuraanslagen kunnen stoppen
Vier manieren waarop sociale-mediaplatforms de verspreiding van haatdragende inhoud in de nasleep van terreuraanslagen kunnen stoppen Verkenning van oceaan en ruimte bij URIs Graduate School of Oceanography
Verkenning van oceaan en ruimte bij URIs Graduate School of Oceanography Het gaat naar 11:lab in Florida vestigt nieuw record voor magneetsterkte
Het gaat naar 11:lab in Florida vestigt nieuw record voor magneetsterkte Onderzoek heroverweegt zelfstudieonderwijs
Onderzoek heroverweegt zelfstudieonderwijs Facebooks Workplace claimt twee miljoen gebruikers
Facebooks Workplace claimt twee miljoen gebruikers Het massale surveillanceregime van Groot-Brittannië verzet zich rechtstreeks tegen de mensenrechten
Het massale surveillanceregime van Groot-Brittannië verzet zich rechtstreeks tegen de mensenrechten Is er fossiel bewijs voor de menselijke evolutie?
Is er fossiel bewijs voor de menselijke evolutie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

