
Wetenschap
Onderzoekers onthullen hoe enzymbewegingen reacties katalyseren
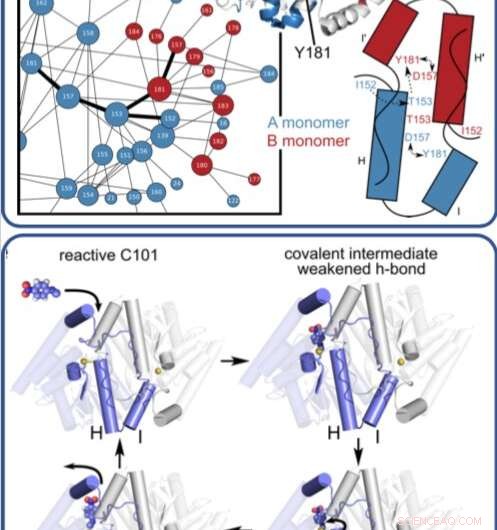
Deze illustratie laat zien hoe een enzym beweegt en verandert terwijl het complexe reacties katalyseert en organische verbindingen afbreekt. Credit: Proceedings van de National Academy of Sciences
In een in de tijd opgelost röntgenexperiment, onderzoekers ontdekt, met atomaire resolutie en in realtime, de voorheen onbekende manier waarop een microbieel enzym organische verbindingen afbreekt.
Het team, onder leiding van Mark Wilson van de Universiteit van Nebraska Lincoln (UNL) en Henry van den Bedem van het SLAC National Accelerator Laboratory van het Department of Energy (nu bij Atomwise Inc.), publiceerden hun bevindingen vorige week in de Proceedings van de National Academy of Sciences . Wat ze over dit enzym hebben geleerd, waarvan de structuur vergelijkbaar is met een die is betrokken bij neurodegeneratieve ziekten zoals Parkinson, zou kunnen leiden tot een beter begrip van hoe antibiotica door microben worden afgebroken en tot de ontwikkeling van effectievere medicijnen.
Eerder, de onderzoekers gebruikten SLAC's Stanford Synchrotron Radiation Lightsource (SSRL) om de structuur van het enzym bij zeer lage temperaturen te verkrijgen met behulp van röntgenkristallografie. In dit onderzoek, Medhanjali Dasgupta, een UNL-afgestudeerde student die de eerste auteur van de studie was, gebruikte de Linac Coherent Light Source (LCLS), SLAC's röntgenlaser, om het enzym en zijn substraat in het kristal te zien bewegen en veranderen terwijl het bij kamertemperatuur door een volledige katalytische cyclus ging.
De wetenschappers gebruikten speciale software, ontworpen door van den Bedem, die zeer gevoelig is voor het identificeren van eiwitbewegingen uit röntgenkristallografiegegevens om de resultaten te interpreteren, het onthullen van nooit eerder vertoonde bewegingen die een sleutelrol spelen bij het katalyseren van complexe reacties, zoals het afbreken van antibiotica. Volgende, de onderzoekers hopen LCLS te gebruiken om structuren op kamertemperatuur van andere enzymen te verkrijgen om beter te kunnen zien hoe de bewegingen die daarin plaatsvinden, helpen bij het verplaatsen van reacties.
 Koolstofterugkoppeling van bosbodems zal de opwarming van de aarde versnellen, 26-jarige studieprojecten
Koolstofterugkoppeling van bosbodems zal de opwarming van de aarde versnellen, 26-jarige studieprojecten Kunnen we plastic ooit vervangen?
Kunnen we plastic ooit vervangen?  Hoe de graslanden te beschrijven Biome
Hoe de graslanden te beschrijven Biome Eerste luchtkwaliteitsprofiel van twee sub-Sahara Afrikaanse steden vindt verontrustend nieuws
Eerste luchtkwaliteitsprofiel van twee sub-Sahara Afrikaanse steden vindt verontrustend nieuws Grootte van bosbrand in Oregon onderstreept uitgestrektheid van het westen van de VS
Grootte van bosbrand in Oregon onderstreept uitgestrektheid van het westen van de VS
Hoofdlijnen
- Wetenschapper duikt in honderden onderwatergrotten op zoek naar nieuwe vormen van leven
- Onderzoekers bieden visserij een oplossing voor overbevissing
- Cannabis kweken met moderne wetenschap en technologie
- Antropologen beschrijven derde orang-oetansoort
- Haaien evolueerden vliegtuigachtige attributen om in habitats te passen
- Hoe zijn cellen, weefsels en organen verwant?
- Voorbeelden van archaebacteriën met hun wetenschappelijke naam en classificatie
- Seizoensgebonden afbeeldingen onthullen de wetenschap achter stamcellen
- Wat zijn de sporten op het DNA Dubbelschroef gemaakt van?
- Bioluminescente worm met ijzeren superkrachten

- Aanhoudende fotogeleiding gebruikt om neurotypische cellen te stimuleren

- Chemici nemen de plek waar water en lucht samenkomen onder de loep
- 3D-printen creëert superzachte structuren die hersenen en longen nabootsen
- Lichtgevoelige E. coli functionele biofilms als steigers voor hydroxyapatietmineralisatie
 We kunnen luchthavens niet uitbreiden nadat we een klimaatnoodtoestand hebben uitgeroepen - laten we in plaats daarvan overschakelen op koolstofarm transport
We kunnen luchthavens niet uitbreiden nadat we een klimaatnoodtoestand hebben uitgeroepen - laten we in plaats daarvan overschakelen op koolstofarm transport Koude temperaturen gekoppeld aan hoge status
Koude temperaturen gekoppeld aan hoge status Differentiaaldruk converteren naar Flow
Differentiaaldruk converteren naar Flow Afvaleilanden voor de kust van Midden-Amerika duiden op een probleem met oceaanvervuiling
Afvaleilanden voor de kust van Midden-Amerika duiden op een probleem met oceaanvervuiling Moeilijk uit te rekken silicium wordt superelastisch
Moeilijk uit te rekken silicium wordt superelastisch EPDM sluitring ten opzichte van nitril rubberen ring
EPDM sluitring ten opzichte van nitril rubberen ring  Nissan-Renault op gladdere weg, maar verkeersdrempels dreigen:analisten
Nissan-Renault op gladdere weg, maar verkeersdrempels dreigen:analisten Studie onderzoekt de keerzijde van klassenclown worden genoemd
Studie onderzoekt de keerzijde van klassenclown worden genoemd
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

