
Wetenschap
Moleculaire basis van effecten van medicijnen op de ontwikkeling van ledematen en oren onthuld
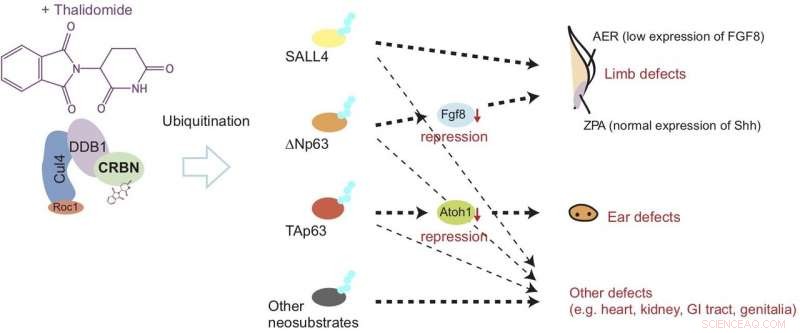
Thalidomide bindt zich aan het cereblon (CRBN) en veroorzaakt abnormale ontwikkeling van ledematen en oren door de afbraak van eiwitten genaamd ?Np63α en TAp63α te induceren via een proces dat bekend staat als ubiquitinatie. Dit model suggereert dat de defecten worden veroorzaakt door downregulatie van groeifactoren genaamd Fgf8 en Atoh1. Credit: Natuur Chemische Biologie
Onderzoekers in Japan en Italië hebben meer inzicht gekregen in de manier waarop thalidomide ontwikkelingsstoornissen op moleculair niveau veroorzaakt. Een internationale studie, mede geschreven door onderzoekers van het Tokyo Institute of technology (Tokyo Tech) en de Tokyo Medical University, heeft een gedetailleerd beeld opgeleverd van hoe thalidomide, een van de meest beruchte medicijnen ooit ontwikkeld, veroorzaakt afwijkingen in de ontwikkeling van ledematen en oren. De bevindingen kunnen bijdragen aan het opnieuw opduiken van veilige, of niet-teratogeen, van thalidomide afgeleide geneesmiddelen voor de behandeling van kanker en ontstekingsziekten.
Oorspronkelijk gebruikt in de late jaren 1950 als een behandeling voor ochtendmisselijkheid, bewijsmateriaal in het begin van de jaren zestig bracht thalidomide in verband met afwijkingen, waaronder verkorte ledematen en defecte organen, wat leidde tot het wereldwijde verbod. Opmerkelijk, gebaseerd op latere bevindingen die de ontstekingsremmende en andere gunstige eigenschappen van thalidomide benadrukten, het medicijn is een belangrijk voorbeeld geworden van een medicijn dat kan worden hergebruikt om aandoeningen zoals lepra en multipel myeloom te behandelen, een type bloedkanker.
"De thalidomide-tragedie is geen open en gesloten geval in de medische geschiedenis, maar is aan de gang, aangezien er nieuwe thalidomide-baby's zijn geboren na de hernieuwde goedkeuring rond 2000, ", legt biochemicus Yuki Yamaguchi van Tokyo Tech uit. "Maar we weten nu dat thalidomide en de daarvan afgeleide geneesmiddelen zeer effectief zijn en gepaard gaan met weinig bijwerkingen, behalve de teratogene effecten op de foetus, in tegenstelling tot veel andere conventionele middelen tegen kanker. Daarom, teratogeniteit blijft een grote hindernis voor een bredere toepassing van deze veelbelovende geneesmiddelen."
Om de mechanismen achter thalidomide-activiteit in meer detail te onderzoeken, Yamaguchi werkte samen met Hiroshi Handa van de Tokyo Medical University, Luisa Guerrini van de Universita degli Studi di Milano, Italië, en anderen om ontwikkelingsstudies uit te voeren met de zebravis als modelorganisme. Deze samenwerking was bedoeld om Guerrini's vermoeden te onderzoeken dat de p63-familie van eiwitten een cruciale rol zou kunnen spelen. In 2010, een team onder leiding van Handa en Yamaguchi bereikte een doorbraak door het cereblon te identificeren als een sleuteleiwit waardoor thalidomide zijn nadelige of teratogene effecten initieert.
Nutsvoorzieningen, de laatste studie gepubliceerd in Natuur Chemische Biologie laat zien dat na binding aan cereblon, thalidomide veroorzaakt schade aan vinnen (overeenkomend met ledematen) en gehoorblaasjes (overeenkomend met oren) door de afbraak van twee soorten p63-eiwit te induceren. specifiek, de studie suggereert dat de afbraak van ΔNp63α resulteert in ledemaatdefecten, terwijl die van TAp63α leidt tot oorafwijkingen, zoals weergegeven in figuur 1.
Begrijpen hoe het cereblon werkt om de effecten van thalidomide te mediëren, zou de manier waarop medicijnen worden ontwikkeld kunnen transformeren - weg van toevallige ontdekkingen en in de richting van rationeel moleculair ontwerp. "De verandering zou zijn als een verschuiving van het zoeken naar een naald in een hooiberg naar het uithakken van een naald uit bot, ' merkt Yamaguchi op.
"Het is waarschijnlijk dat we in de nabije toekomst de ontwikkeling van nieuwe op thalidomide gebaseerde geneesmiddelen zonder teratogene effecten zullen zien, " hij zegt.
 Opwarming van de aarde kan leiden tot verliezen voor de Europese wijnindustrie
Opwarming van de aarde kan leiden tot verliezen voor de Europese wijnindustrie Hoe weten wetenschappers of dinosaurusfossielen mannelijk of vrouwelijk zijn?
Hoe weten wetenschappers of dinosaurusfossielen mannelijk of vrouwelijk zijn?  Everglades restauratierapport toont succes, maar klimaatverandering blijft een uitdaging
Everglades restauratierapport toont succes, maar klimaatverandering blijft een uitdaging Griekenland in rouw omdat er nog een aantal vermist wordt na dodelijke overstroming
Griekenland in rouw omdat er nog een aantal vermist wordt na dodelijke overstroming Nog twee doden door record zware regen in Japan
Nog twee doden door record zware regen in Japan
Hoofdlijnen
- Chimpansees bleken arm- en monduitdrukkingen te gebruiken om afstand over te brengen
- Paarse plant is in de verdediging
- Nieuwe bevindingen over de biomechanica en evolutie van zuigvallen in vleesetende blaasjes
- De verschillen tussen monosachariden en polysachariden
- Clathrin-assemblage definieert het begin en de geometrie van corticale patronen
- Septate versus niet-Septate Hyphae
- Wat zijn de primaire functies van fosfolipiden?
- Wat gebeurt er als een kind met een extra chromosoom wordt geboren in het 23e paar?
- Doel van een Cell
- Ingenieursreactor zet gas direct om in azijnzuur

- Moleculen in collectieve extase

- Veenbessen kunnen darmgezondheidsproblemen voor vleeseters verminderen

- Ingenieurs ontdekken waarom gevallen bladeren op treinrails zo glad zijn

- Nieuwe reactie maakt indoline-steigers beschikbaar voor farmaceutische ontwikkeling

 Grootte van het huis een factor bij het aanpakken van de wereldwijde noodsituatie in het klimaat
Grootte van het huis een factor bij het aanpakken van de wereldwijde noodsituatie in het klimaat Stergeboorte met kans op wind?
Stergeboorte met kans op wind? Mooi in roze en onstuimig in blauw?
Mooi in roze en onstuimig in blauw? De structuur van een actieve galactische kern
De structuur van een actieve galactische kern Schokkende economie
Schokkende economie Door de mens veroorzaakte opwarming heeft waarschijnlijk geleid tot een recente reeks recordbrekende temperaturen:studie
Door de mens veroorzaakte opwarming heeft waarschijnlijk geleid tot een recente reeks recordbrekende temperaturen:studie Hotel Ruthenium:hoe waterstof incheckt maar nooit weggaat
Hotel Ruthenium:hoe waterstof incheckt maar nooit weggaat Google bevestigt dat het een betaalpas wil vrijgeven
Google bevestigt dat het een betaalpas wil vrijgeven
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

