
Wetenschap
X-ray laser sight onthult medicijndoelen

Krediet:Elena Khavina/MIPT
Onderzoekers van het Moscow Institute of Physics and Technology hebben een recensie gepubliceerd over seriële femtoseconde kristallografie, een van de meest veelbelovende methoden voor het analyseren van de tertiaire structuur van eiwitten. Deze techniek is de afgelopen tien jaar snel geëvolueerd, nieuwe perspectieven openen voor het rationele ontwerp van geneesmiddelen die zich richten op eiwitten die voorheen ontoegankelijk waren voor structurele analyse. Het artikel verscheen in het tijdschrift Deskundig advies over het ontdekken van geneesmiddelen .
X-ray kristallografie
Röntgenkristallografie is een van de belangrijkste methoden voor het onthullen van de 3D-structuur van biologische macromoleculen, zoals eiwitten. Het heeft geholpen bij het bepalen van de structuur van talrijke farmacologisch belangrijke enzymen en receptoren, waardoor het ontwerp van geneesmiddelen die op deze eiwitten zijn gericht, mogelijk is.
De methode omvat het kristalliseren van een eiwit en het bestuderen ervan via röntgendiffractie. Eerst wordt het eiwit geïsoleerd en gezuiverd. Daarna droogt het oplosmiddel geleidelijk uit. Als resultaat, de moleculen waarvan de structuur wordt onderzocht, vormen kristallen, gekenmerkt door een interne orde. Door een kristal bloot te stellen aan röntgenstralen in een speciaal apparaat, onderzoekers verkrijgen een diffractiepatroon. Het bevat informatie over de posities van atomen in het kristal. Een nauwkeurige analyse van het patroon onthult de 3D-structuur van de samenstellende eiwitmoleculen.
Voor de komst van deze methode, nieuwe geneesmiddelen werden meestal empirisch gezocht:ofwel door de structuur van de moleculen te veranderen waarvan bekend is dat ze het doeleiwit beïnvloeden, of door arrays van moleculen in chemische bibliotheken te sorteren. Nu de 3D-structuren van veel doeleiwitten beschikbaar zijn, onderzoekers kunnen ze op een computerscherm bekijken en snel miljoenen verbindingen doorzoeken op zoek naar kandidaat-geneesmiddelen. Op die manier besparen ze veel tijd en geld die voorheen werden besteed aan chemische synthese en "natte" experimenten.
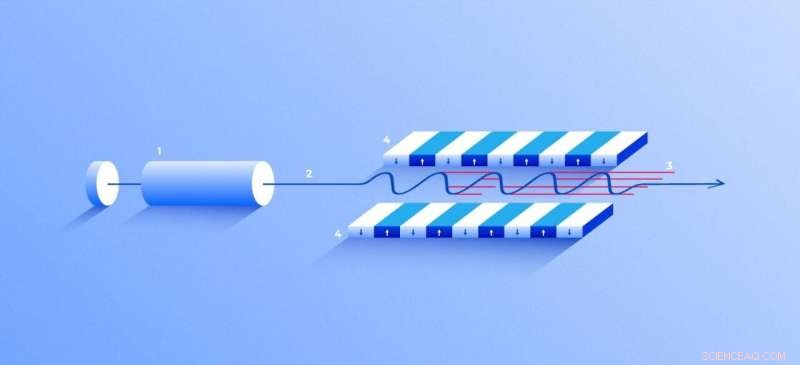
Röntgenlaser met vrije elektronen. Een bron (1) zendt vrije elektronen (2) uit die slechts tientallen keren langzamer bewegen dan de lichtsnelheid door de undulator (4), een tunnel met veel magneten. Het magnetische veld zorgt ervoor dat een elektron dat door de tunnel reist, oscilleert en daarom röntgenstralen uitzendt. De beweging van de elektronen in de undulator is gesynchroniseerd om strakke, hoogfrequente röntgenpulsen van opmerkelijke intensiteit (3). Krediet:Elena Khavina/MIPT
Röntgenkristallografie levert goede resultaten op voor kristallen die groot zijn, stal, en homogeen - dat wil zeggen, zonder onzuiverheden of structurele gebreken. Om een zwak diffractiesignaal beter te detecteren, een krachtige stralingspuls nodig is, maar niet zo krachtig om het kristal te vernietigen. Bij conventionele röntgenkristallografie, een eiwitkristal wordt geroteerd in de röntgenstraal om diffractiepatronen voor verschillende ruimtelijke oriëntaties te produceren. Hiermee wordt maximale informatie over de constructie vastgelegd.
Methode voor lastige doelen
Kort nadat röntgenkristallografie opkwam, het werd duidelijk dat niet alle biologische macromoleculen kunnen worden gekristalliseerd. Sommige eiwitten worden gewoonlijk opgelost in het binnenste celmedium. Dus het is vrij eenvoudig om ze in oplossing te brengen, verdamp het, en verkrijg een groot regelmatig kristal. Maar membraaneiwitten, veel receptoren onder hen, vormen kristallen die niet groot en zuiver genoeg zijn voor standaard röntgenkristallografie. Dat gezegd hebbende, veel van deze eiwitten zijn betrokken bij de ontwikkeling van ziekten, wat betekent dat hun structuur van groot belang is voor farmacologen.
Minder dan een decennium geleden, er is een oplossing gevonden voor membraaneiwitten. Deze nieuwe techniek, seriële femtoseconde röntgenkristallografie genoemd, of SFX, vertrouwt op röntgenvrije-elektronenlasers, ontwikkeld kort voor SFX.
Alexey Misjin, plaatsvervangend hoofd van het Laboratorium voor Structurele Biologie van Receptoren bij MIPT, die co-auteur was van de studie, legde uit:"Wat het tot een baanbrekende technologie maakt, is een zeer hoge energiedichtheid van de laserpuls. Het object wordt blootgesteld aan zo'n krachtige straling dat het uit elkaar valt, onvermijdelijk en bijna onmiddellijk. Maar voordat het zover is, enkele individuele quanta van de laserpuls verstrooien van het monster en komen bij de detector terecht. Dit is het zogenaamde diffraction-before-destruction-principe om de structuur van het oorspronkelijke eiwit te bestuderen."

Twee manieren om kristallen in het werkgebied van het apparaat te voeren:in een vloeistofstroom (3, links) en op een stevige ondergrond (3, Rechtsaf). In beide gevallen, de röntgenstraal (2) die door kristallen gaat, genereert een diffractiepatroon op het scherm (1). Krediet:Elena Khavina/MIPT
Röntgenlasers met vrije elektronen zijn buiten de biologie nuttig gebleken:in de afgelopen jaren SFX wordt steeds vaker gebruikt door natuur- en scheikundigen, te. Het eerste apparaat kwam in 2009 beschikbaar voor onderzoekers en nu zijn er vijf centra open voor onderzoekers in de VS, Japan, Zuid-Korea, Duitsland, en Zwitserland. Er wordt een nieuwe gebouwd in China, en de Amerikaanse faciliteit - historisch gezien de eerste - heeft plannen aangekondigd voor modernisering.
Hoewel de nieuwe technologie onderzoekers een kijkje heeft gegeven in de structuur van eiwitten die voorheen aan analyse ontsnapten, het heeft ook nieuwe technische en wiskundige oplossingen gepromoot. Conventionele röntgenkristallografie omvat het blootstellen van één kristal aan straling vanuit verschillende hoeken en het gezamenlijk analyseren van de resulterende diffractiepatronen. Bij SFX, het kristal wordt onmiddellijk vernietigd door de eerste interactie met een krachtige röntgenpuls. Dus onderzoekers moeten het proces herhalen met veel kleine kristallen en de zo gegenereerde "seriële" gegevens analyseren, vandaar de naam van de methode.
Een andere uitdaging is het selecteren van de samples voor SFX. Bij conventionele röntgenkristallografie, gewoon kiezen voor het grootste kristal van de hoogste kwaliteit was de juiste keuze. Dit kan handmatig, door de beschikbare monsters te bekijken. De nieuwe procedure vereist het werken met een suspensie van veel kleine kristallen van verschillende grootte en kwaliteit. Centrifuges en filters met bekende poriënafmetingen worden gebruikt om de kristallen op grootte te scheiden.
Methoden voor het plaatsen van monsters in de kamer moesten worden uitgewerkt, te. Röntgenlasers met vrije elektronen hebben een bepaalde maximale frequentie waarmee ze stralingspulsen kunnen uitzenden. Om de kosten en het tijdverbruik te verminderen, nieuwe kristallen moeten met dezelfde frequentie in de kamer worden gevoerd. Tot dusver, Hiervoor zijn twee benaderingen ontwikkeld. Onder de eerste, de kristallen komen de kamer binnen in een vloeibare suspensie, geleverd door een injector. De straal die de injector verlaat, wordt "geperst" door een stroom gas om een correcte plaatsing van het monster te verzekeren. Dat is, bij het passeren, een kristal komt precies in het midden van de laserstraal terecht (fig. 2, links). Alternatief, de eiwitkristallen kunnen over een voor röntgenstraling transparant substraat worden verspreid en voor elke puls automatisch in de laserstraal worden gevoerd (fig. 2, Rechtsaf).
Sinds de eerste resultaten in 2011 SFX heeft meer dan 200 eiwitstructuren onthuld. Onder hen zijn 51 doelwitten die mogelijk belangrijk zijn voor de farmacologie:membraanreceptoren, fermenten, virale eiwitten, enz. - die voorheen ontoegankelijk waren voor conventionele analytische technieken.
De systematische review van de technologie zoals toegepast op biologie en farmacologie door het MIPT-team zal ongetwijfeld andere onderzoekers helpen die de structuren van belangrijke medicijndoelen willen verkrijgen om nieuwe medicijnen te ontwikkelen.
 Titratie van natriumcarbonaat met zoutzuur
Titratie van natriumcarbonaat met zoutzuur Gemultiplexte biosensoren in het voordeel van de gezondheidszorg
Gemultiplexte biosensoren in het voordeel van de gezondheidszorg Een nieuwe fluorescerende sonde die B-cellen van T-cellen kan onderscheiden
Een nieuwe fluorescerende sonde die B-cellen van T-cellen kan onderscheiden Eenvoudige methode voorgesteld voor microfabricage op niet-vlakke substraten
Eenvoudige methode voorgesteld voor microfabricage op niet-vlakke substraten De leiding nemen:onderzoekers werken samen om betere batterijen te maken
De leiding nemen:onderzoekers werken samen om betere batterijen te maken
 Studie werpt nieuw licht op de reactie van bossen op luchtvervuiling
Studie werpt nieuw licht op de reactie van bossen op luchtvervuiling 's Werelds eerste database met wetten voor het verwijderen van kooldioxide
's Werelds eerste database met wetten voor het verwijderen van kooldioxide NASA-NOAA's Suomi NPP-satelliet vindt een zwakkere tropische storm Leepi
NASA-NOAA's Suomi NPP-satelliet vindt een zwakkere tropische storm Leepi De aarde bloedde tot de 3e heetste augustus, zomer op record
De aarde bloedde tot de 3e heetste augustus, zomer op record Hoe koel je een stad in een opwarmende wereld?
Hoe koel je een stad in een opwarmende wereld?
Hoofdlijnen
- Een genetische opstand in het vroege leven voorkomen
- Wat zijn de verschillen tussen een centraal zenuwstelsel en een centraal zenuwstelsel?
- Wat zijn de oorzaken van genotype en fenotype?
- Kun je leven zonder zuurstof? Dit dier kan
- Hoe doodt alcohol bacteriën?
- Welke pakketten materialen van het endoplasmatisch reticulum en verzendt ze naar andere delen van de cel?
- Verdringing in de huid:stamcellen voelen buurtdichtheid om beslissingen te nemen
- Een bacterieel stroomdiagram maken
- Zowel chimpansees als kinderen bleken bereid te betalen om slechte spelers gestraft te zien
- Van melkeiwit, een plastic schuim dat beter wordt in een moeilijke omgeving

- Onderzoekers ontwikkelen een methode om miljoenen potentiële zelfgeproduceerde kandidaat-geneesmiddelen in één keer te onderzoeken

- Ingenieurs produceren duurzame, energiedichtheid batterij

- Hoe de pakkingsfractie van een diamantrooster te berekenen

- Kunstmatig enzym kan een gen-switch activeren
 Diagrammen ongelijkheden op een getallenlijn tekenen
Diagrammen ongelijkheden op een getallenlijn tekenen Wetenschapper onderzoekt het mysterie van secundaire ijsproductie
Wetenschapper onderzoekt het mysterie van secundaire ijsproductie Verbetering van de verticale mobiliteit van de zesbenige robot RHex met behulp van microspines
Verbetering van de verticale mobiliteit van de zesbenige robot RHex met behulp van microspines Wetenschappers vinden bewijs van de vorming van platinametalen onder de 60 miljoen jaar oude Schotse vulkaan
Wetenschappers vinden bewijs van de vorming van platinametalen onder de 60 miljoen jaar oude Schotse vulkaan Mind-controlerende moleculen van wespengif kunnen op een dag Parkinson-patiënten helpen
Mind-controlerende moleculen van wespengif kunnen op een dag Parkinson-patiënten helpen Niet-gegradueerde biologieboeken leren niet hoe wetenschap de praktijk in de industrie kan verbeteren
Niet-gegradueerde biologieboeken leren niet hoe wetenschap de praktijk in de industrie kan verbeteren Een wetenschapsproject waarbij nagellak langer meegaat
Een wetenschapsproject waarbij nagellak langer meegaat Bloomberg leidt massacoalitie die steun betuigt aan klimaatakkoord van Parijs
Bloomberg leidt massacoalitie die steun betuigt aan klimaatakkoord van Parijs
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

