
Wetenschap
Mechanisme van remming van schorpioentoxine van K+-kanaal opgehelderd met behulp van snelle AFM
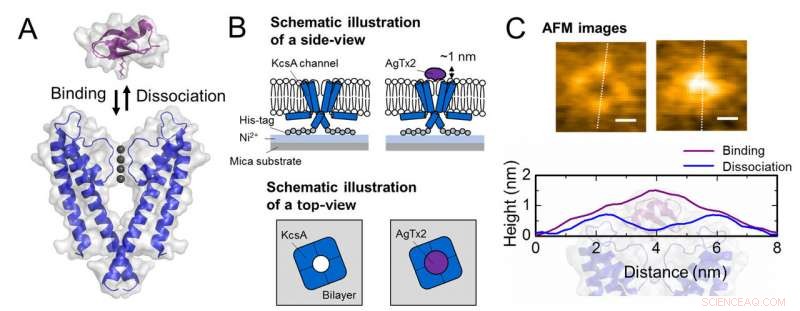
Schema van associatie en dissociatie van kaliumkanaal KcsA (Q58A/T61S/R64D) en AgTx2 en representatieve AFM-beelden. A. Associatie (binding) van KcsA en AgTx2. B. Schema met een exemplaar voor AFM-observatie.
C. Representatieve AFM-afbeeldingen en met afmetingen weergegeven als witte stippellijnen. Bar, 2 nm. Krediet:Kanazawa University
Agitoxine-2 (AgTx2) uit schorpioengif is een krachtige blokker van K+-kanalen. Onderzoekers hebben nu de bindingsdynamiek van AgTx2 aan het KcsA-kanaal waargenomen met behulp van snelle atoomkrachtmicroscopie. Kinetische analyses met één molecuul onthulden dat de affiniteit van het kanaal voor AgTx2 toenam tijdens aanhoudende binding en afnam tijdens aanhoudende dissociatie. De onderzoekers stellen een vierstatenmodel voor met relevante snelheidsconstanten. Een geïnduceerde-fit route was dominant en versnelde binding met 400 keer.
Celmembranen bevatten ionenkanalen die de permeatie van verschillende ionen tussen de binnen- en buitenkant van de cel reguleren. Ionenkanalen zijn eiwitten, en als reactie op diverse prikkels, ze laten specifieke ionen doordringen. Op deze manier regelt de cel de elektrische signalen die aan de basis liggen van de functie van spieren en het zenuwstelsel. Aangezien een storing van ionkanalen een aantal aandoeningen veroorzaakt, zoals een hartinfarct en epilepsie, het is belangrijk om het werkingsmechanisme te begrijpen van moleculen die de functies van ionenkanalen belemmeren.
Er is gevonden dat schorpioengif meer dan 200 verbindingen bevat die zich binden aan K+-kanalen. Onder hen, AgTx2 is een peptide dat bestaat uit 38 aminozuurresiduen. Eerdere studies toonden aan dat door binding aan het K+-kanaal van buiten het celmembraan, AgTx2 blokkeert de K+-kanaalporie en remt K+-permeatie. Echter, het gedetailleerde moleculaire mechanisme bleef onbekend, bijv. of de bindingsdynamiek kan worden verklaard door een tweestatenmodel van associatie en dissociatie.
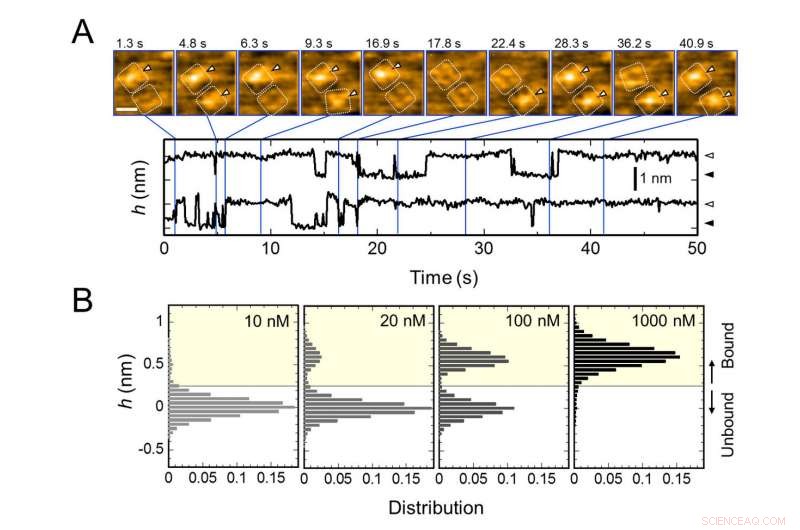
Herhaalde binding van AgTx2 aan kaliumkanaal KcsA en AgTx2 - concentratieafhankelijkheid van bindingskans. A. Time-lapse-beelden van AgTx2-binding aan en dissociatie van de KcsA-kanalen en tijdsverloop van de gemiddelde hoogte (h) (nm) rond het midden van het extracellulaire oppervlak. Schaalbalk in het HS-AFM-beeld, 5 nm. B. Hoogtehistogrammen van h afhankelijk van AgTx2-concentratie in de oplossing. Krediet:Kanazawa University
Het onderzoeksteam, waaronder wetenschappers van de Kanazawa University, visualiseerde de associatie en dissociatie van AgTx2 met het K + kanaal KcsA met behulp van snelle atoomkrachtmicroscopie (HS-AFM) en voerde een gedetailleerde analyse van de dynamiek uit (Figuur 1). KcsA is een tetrameer, zijn subeenheden vormen een ringachtige structuur. Na binding van AgTx2 aan het tetrameeroppervlak, het centrale deel van het kanaal, d.w.z. de passage voor K+, leek opgezwollen als gevolg van AgTx2-binding. De binding en dissociatie van AgTx2 aan het K+-kanaal kan herhaaldelijk plaatsvinden en de hoogte rond het kanaalcentrum veranderde dienovereenkomstig (Figuur 2).
Wanneer de AgTx2-concentratie in de oplossing hoog was, de bindingskans was ook hoog. Tijdsverlopen van de binding en dissociatie onthulden dat na binding van AgTx2 aan KcsA, de conformatie van KcsA veranderd, waardoor AgTx2 gemakkelijker kon binden, en dat zelfs bij dissociatie van AgTx2, een ander AgTx2-molecuul zou zeer snel aan KcsA kunnen binden; dit wordt een 'induced-fit'-mechanisme genoemd. Anderzijds, werd geconstateerd dat, wanneer er voldoende tijd is verstreken na AgTx2-dissociatie, de conformatie van KcsA veranderde terug naar het origineel, waaraan AgTx2 minder gemakkelijk bond.
Deze resultaten geven aan dat de bindingsdynamiek niet kan worden verklaard met een eenvoudig tweestatenmodel, dat wil zeggen binding en dissociatie. Het leek erop dat zowel de associatie- als de dissociatietoestanden van KcsA konden worden onderscheiden als ten minste twee subtoestanden; Daarom werd een associatiemodel met vier staten overwogen (Figuur 3). Toen de reactiesnelheden werden berekend voor een model met vier toestanden, weerspiegelden de verkregen snelheden die welke experimenteel werden verkregen. Een simulatie van de bindingsdynamiek met dit vierstatenmodel en de bijbehorende reactiesnelheden, toonde aan dat AgTx2-binding voornamelijk via de geïnduceerde-fit-route verloopt. Verder, er werd gevonden dat de geïnduceerde fit de binding van AgTx2 met een factor 400 versnelde. Dus, het mechanisme van AgTx2 om de functie van KcsA efficiënt te remmen is opgehelderd (Figuur 3).
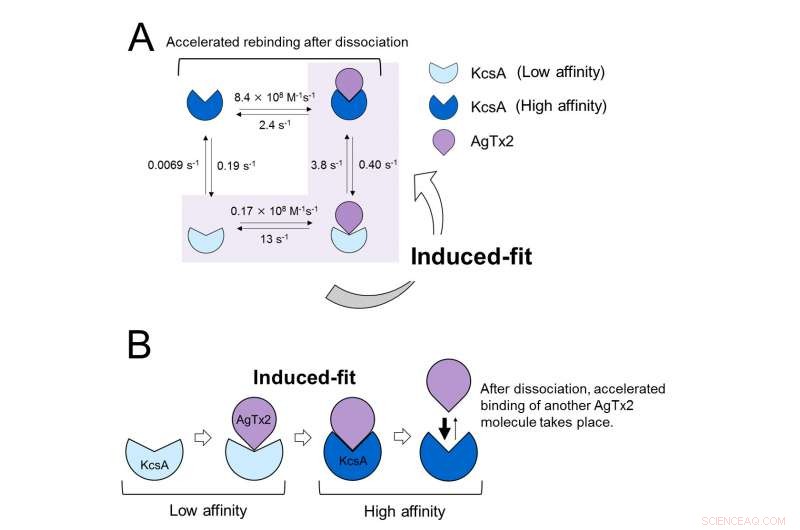
Bindingsdynamiekmodel van AgTx2 en kaliumkanaal KcsA. A. Snelheidsconstanten van reactiestappen. B. Versnelde binding van AgTx2 aan kaliumkanaal KcsA via mechanisme voor geïnduceerde fit. Krediet:Kanazawa University
De HS-AFM-observatietechniek en -methode die worden gebruikt voor de analyse van de binding van het K+-kanaal en de peptideremmer kunnen worden toegepast op een grote verscheidenheid aan biologische moleculen. Ze kunnen worden toegepast op analyses van een ligand die aan zijn receptor bindt, evenals op associatie van DNA en een DNA-bindend eiwit. Deze studie zal naar verwachting de opheldering van de bindingsdynamiek van verschillende biologische moleculen versnellen.
De studie is gepubliceerd in wetenschappelijke vooruitgang .
 Dalian Coherent Light Source onthult nieuwe dissociatiekanalen in ethaanfotochemie
Dalian Coherent Light Source onthult nieuwe dissociatiekanalen in ethaanfotochemie De weg verlichten voor het verwijderen van radioactieve elementen
De weg verlichten voor het verwijderen van radioactieve elementen Verbrandingsgedrag van aromaten kan de sleutel zijn tot het verbeteren van de extractie van zware olie
Verbrandingsgedrag van aromaten kan de sleutel zijn tot het verbeteren van de extractie van zware olie De lange en de korte van DNA-replicatie
De lange en de korte van DNA-replicatie Onderzoekers bedenken nieuwe methode om lood uit filters te halen betere hoeveelheid in kraanwater afmeten
Onderzoekers bedenken nieuwe methode om lood uit filters te halen betere hoeveelheid in kraanwater afmeten
Hoofdlijnen
- Verschillen tussen lichaamscellen en neuronen
- Nieuwe aanpak kan de sleutel zijn tot de behandeling van antibioticaresistente bacteriën
- Hoe biologische antropologie werkt
- Onderzoek toont aan dat walvissen, al een bedreigde diersoort, kan een vage toekomst tegemoet gaan
- Honden in de winter beschermen tegen extreme kou, ijs, zout en deicers
- Het sluiten van wegen gaat de effecten van habitatverlies voor grizzlyberen tegen
- Waarom vallen mensen steeds uit?
- Het grote structurele voordeel Eukaryoten hebben over prokaryoten
- Hoe ver ben je van de boom gevallen? Wetenschappers schatten de mutatiesnelheid van chimpanseeouders tot hun nakomelingen
- Gevriesdroogde aardbeien en ijs zorgen voor een zeer stabiele relatie

- Duurzame ijzerkatalyse maakt controleerbare alkeenborylering mogelijk
- Vorming van celmembraancomponentdomeinen in kunstmatige lipidedubbellaag

- Een ongrijpbare ontbrekende schakel isoleren

- Onderzoekers ontdekken nieuwe structuur voor veelbelovende materiaalklasse

 Het oplossen van problemen helpt leerlingen om wiskunde te leren
Het oplossen van problemen helpt leerlingen om wiskunde te leren Gereduceerd grafeenoxide versierd met metalen nanodeeltjes vertoont een groot potentieel voor gasdetectie
Gereduceerd grafeenoxide versierd met metalen nanodeeltjes vertoont een groot potentieel voor gasdetectie Wat zijn lumens van licht?
Wat zijn lumens van licht?  Zijn wetenschappelijke laboratoria echt inclusief als ze niet toegankelijk zijn voor hulphondengeleiders?
Zijn wetenschappelijke laboratoria echt inclusief als ze niet toegankelijk zijn voor hulphondengeleiders? Vier hoofdonderdelen van een fabriek
Vier hoofdonderdelen van een fabriek  Ecologische zorgen die de toendra beïnvloeden
Ecologische zorgen die de toendra beïnvloeden  Atomic mismatch creëert nano-halters
Atomic mismatch creëert nano-halters Steun Indonesiërs voor doodstraf neemt af met strengere onderzoeksmethoden
Steun Indonesiërs voor doodstraf neemt af met strengere onderzoeksmethoden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

