
Wetenschap
De lange en de korte van DNA-replicatie

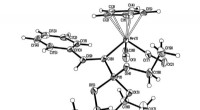
KAUST-wetenschappers, waaronder eerste auteur Manal Zaher, ontdekte dat het enzym FEN1 als schakelaar fungeert tijdens DNA-replicatie. Krediet:KAUST
Het proces van het kopiëren van DNA is een complexe choreografie die hoge snelheden en uiterste precisie vereist. Door de ingewikkelde details van dit proces te ontdekken, kunnen nieuwe manieren worden gevonden om ziekten aan te pakken, zoals kanker, en KAUST-wetenschappers hebben zojuist een cruciale stap ontdekt.
Het DNA in elke menselijke cel is ongeveer 3 miljard cijfers lang en moet elke keer dat een cel zich deelt, worden gekopieerd, wat bijna 2 biljoen keer per dag gebeurt.
Als er fouten optreden in de DNA-replicatie, cellen kunnen abnormaal worden en ziekte veroorzaken. DNA-code die is gemuteerd om de cel ongecontroleerd te laten delen, bijvoorbeeld, kan leiden tot kanker. Dit maakt het cruciaal om te begrijpen hoe enzymen DNA repliceren en repareren, zegt Manal Zaher, de Ph.D. student in de groep van Samir Hamdan aan KAUST, die de studie leidde.
Zaher onderzocht de enzymen die ervoor zorgen dat korte DNA-strengen worden gevormd tijdens DNA-replicatie, genaamd Okazaki-fragmenten, te verbinden tot een doorlopende DNA-streng.
Door een proces dat bekend staat als de rijping van Okazaki-fragmenten, een enzym genaamd FEN1 snijdt "flappen" af in de Okazaki-fragmenten die moeten worden verwijderd voordat de fragmenten kunnen samenkomen. "Sequentiegebaseerde specificiteit verklaart gedeeltelijk het geheim van replicatiegetrouwheid, echter, we missen belangrijke informatie over de basis voor de op structuur gebaseerde excisie door FEN1 die vereist is op ~ 50 miljoen Okazaki-fragmentplaatsen tijdens menselijke DNA-replicatie, ' legt Hamdan uit.
FEN1 wordt overgeproduceerd of veranderd bij vele vormen van kanker, en Zaher wilde de exacte betrokkenheid van dit enzym onderzoeken.
De onderzoekers gebruikten een beeldvormende techniek genaamd single-molecule FRET om te ontdekken hoe FEN1 aanmeert en vrijkomt uit andere enzymen en DNA-fragmenten.
Zaher was verrast om te ontdekken dat FEN1 fungeerde als een schakelaar tussen twee verschillende enzymroutes. Als de klep kort was, FEN1 koppelde zich aan het DNA om de Okazaki-fragmenten te laten samenkomen. Echter, als de flap lang was, FEN1 stuiterde af, twee andere enzymen, Dna2 en RPA genaamd, bleven achter om aan te meren en het grootste deel van de flap door te snijden voordat FEN1 op zijn beurt binnenkwam om de klus te klaren.
"Dit tweestapsmechanisme zou ons begrip van de regulatie van de daaropvolgende Okazaki-fragmentstappen aanzienlijk kunnen helpen, " legt Zaher uit, "en het is vooral belangrijk omdat mutaties in zowel Dna2 als RPA ook in verband zijn gebracht met kanker."
Hamdan's groep heeft zijn ogen gericht op het onderzoeken van de volgende interactie die FEN1 ondergaat, stap voor stap doorgaan met het ontrafelen van de mysteries van DNA-replicatie.
 Onderzoekers ontvouwen geheime stabiliteit van buigzame rietjes
Onderzoekers ontvouwen geheime stabiliteit van buigzame rietjes Herhalingssleutel tot zelfgenezing, flexibele medische hulpmiddelen
Herhalingssleutel tot zelfgenezing, flexibele medische hulpmiddelen Eerste grootschalige studie van cocaïnegebruikers leidt tot doorbraak in drugstesten
Eerste grootschalige studie van cocaïnegebruikers leidt tot doorbraak in drugstesten Smartphone-schermtechnologie die wordt gebruikt om schadelijke bacteriën te misleiden
Smartphone-schermtechnologie die wordt gebruikt om schadelijke bacteriën te misleiden Een computermodel heeft geleerd prostaatkanker op te sporen
Een computermodel heeft geleerd prostaatkanker op te sporen
 Wat doet de opwarming van de aarde met de wijnindustrie?
Wat doet de opwarming van de aarde met de wijnindustrie?  Satellieten kunnen het risico van dwangarbeid in de vissersvloot van de wereld onthullen
Satellieten kunnen het risico van dwangarbeid in de vissersvloot van de wereld onthullen Hoe te zorgen voor Fireflies
Hoe te zorgen voor Fireflies Experiment met klimaatopwarming vindt onverwachte resultaten
Experiment met klimaatopwarming vindt onverwachte resultaten In oude oceanen die op de onze leken, zuurstofverlies veroorzaakt massa-extinctie
In oude oceanen die op de onze leken, zuurstofverlies veroorzaakt massa-extinctie
Hoofdlijnen
- Sporen van historische rendierweide zijn na 100 jaar nog steeds te zien
- Ontdekking van gewasgenen raakt de wortel van voedselzekerheid
- Wat zijn de verschillen van eenvoudig en gestratificeerd weefsel?
- Wat zijn de stadia van de celcyclus?
- Waarom verplaatsen chloroplasten zich in Elodea?
- Vertrouwen op GPS voorkomt dat delen van uw hersenen worden geactiveerd
- Inzicht in onze levensduur van meer dan 50 jaar die nog steeds in ontwikkeling is, genetische studie toont aan
- Hersenonderzoek onthult hoe insecten de weg naar huis vinden
- Makeup Science Projects
- Zijdevezels kunnen hightech natuurlijke metamaterialen zijn

- Chemici ontdekken een nieuw vormingsmechanisme van stoffen tegen kanker
- Inzicht in 3D-structuur van enzymen kan biobrandstofkosten verlagen
- Een gestroomlijnde benadering voor het bepalen van thermische eigenschappen van kristallijne vaste stoffen en legeringen

- De oorzaak van capaciteitsverlies vinden in een metaaloxide batterijmateriaal

 Bevoorrading van ruimtestation gelanceerd, 2e verzending in 2 dagen
Bevoorrading van ruimtestation gelanceerd, 2e verzending in 2 dagen Veelbelovende tekenen voor Perseverance rover in zijn zoektocht naar vorig leven op Mars
Veelbelovende tekenen voor Perseverance rover in zijn zoektocht naar vorig leven op Mars 5 meest verbazingwekkende grotten
5 meest verbazingwekkende grotten  Het intrekken van een tijdschriftartikel maakt de bevindingen niet vals
Het intrekken van een tijdschriftartikel maakt de bevindingen niet vals Onderzoekers ontwikkelen transparante patch om gevaarlijke voedselbedreigingen te detecteren
Onderzoekers ontwikkelen transparante patch om gevaarlijke voedselbedreigingen te detecteren Nu regeringen kunstmatige intelligentie adopteren, er is weinig toezicht en veel gevaar
Nu regeringen kunstmatige intelligentie adopteren, er is weinig toezicht en veel gevaar Nieuwe bron gevonden voor ultrakorte lichtflitsen
Nieuwe bron gevonden voor ultrakorte lichtflitsen ESA's nieuwe missie om een komeet te onderscheppen
ESA's nieuwe missie om een komeet te onderscheppen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

